

 https://orcid.org/0000-0002-5408-6263
https://orcid.org/0000-0002-5408-6263
Existen pocos datos sobre incidencia y prevalencia de la enfermedad renal crónica (ERC) en la infancia. Es más frecuente en varones. La causa más frecuente son las anomalías estructurales.
El control del hiperparatiroidismo secundario y la normalización de los niveles séricos de calcio, fósforo y vitamina D serán el objetivo del manejo de la enfermedad mineral ósea.
El tratamiento de la anemia se basa en la suplementación de hierro y la administración de AEE. Las alteraciones en el metabolismo hidrosalino y en el control del equilibrio ácido-base suelen estar presentes, acompañadas de una mínima disminución del FG.
La malnutrición es frecuente en los niños con ERC, sobre todo en los menores de dos años con disminución grave del FG. La intervención nutricional será una parte fundamental en su manejo. El retraso de crecimiento en la ERC es multifactorial. La administración de rhGH, en combinación con la corrección de los otros factores implicados mejora el hipocrecimiento.
Existen distintas alternativas terapéuticas para el niño con ERC, cuando ya no es posible el tratamiento conservador de dicha situación: hemodiálisis, diálisis peritoneal y trasplante, siendo el trasplante renal (TR) el tratamiento sustitutivo de elección en el niño con ERC, el que proporciona mejor calidad y expectativa de vida.
Explicar las distintas terapias existentes para la supervivencia y la mejora de vida en los niños con enfermedad renal crónica.
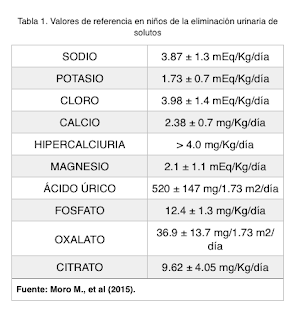
El aparato urinario es el encargado de eliminar los productos de desecho de nuestro organismo, es decir, productos tóxicos nitrogenados, como el amoniaco y la urea, así como iones como Na+, Cl-, SO42-, PO43-, H+, que tienden a acumularse en exceso. La concentración de estos productos en la orina variará en función de las necesidades de eliminación del cuerpo.
El sistema urinario está compuesto por dos riñones, dos uréteres, una vejiga y la uretra, situados en la cavidad abdominal.
El riñón es un órgano par situado en la parte alta de la región retroperitoneal, a ambos lados de los grandes vasos paravertebrales a los que se une por su pedículo vascular, y provisto de un conducto excretor, el uréter, que desemboca en la vejiga urinaria. Está formado por una serie de estructuras vasculares y epiteliales que funcionan en relación estrecha y que lo convierten en el órgano primordial del sistema urinario.
Este sistema es el encargado de formar la orina y de eliminarla del cuerpo. La secreción de orina y su eliminación son cometidos vitales, pues constituyen en conjunto uno de los mecanismos básicos de la homeostasis del medio interno.
Además de desempeñar este papel esencial, el riñón tiene la capacidad de producir hormonas y autacoides (sustancias que actúan en el lugar en el que se producen), como la eritropoyetina, la renina o las prostaglandinas, que tienen gran influencia sobre el control de la tensión arterial, el metabolismo óseo o la formación de glóbulos rojos, y que lo convierten también en un órgano endocrino.
Las funciones que realiza el riñón son posibles gracias a su morfología.
Anatomía macroscópica
Los riñones tienen característicamente forma de habichuela y en la edad adulta llegan a pesar una media de 140 a 150 g y a medir longitudinalmente un promedio de 11,5 cm. En general, el riñón izquierdo es algo más voluminoso que el derecho. Durante la infancia van aumentando de tamaño; de forma que, en los niños, su longitud se correlaciona muy directamente con la talla.
Longitud renal determinada por gammagrafía Tc99m-DMSA según edad en niños mayores de un año:
Los riñones están situados detrás del peritoneo parietal contra la pared posterior del abdomen, un poco por fuera de las apófisis transversas de la 11ª y 12ª vértebras dorsales y las dos primeras vértebras lumbares, dentro de una celda celuloadiposa cerrada, limitada por una fascia perirrenal de tejido conectivo, que los fija a las estructuras adyacentes y ayuda a que conserven su situación normal, con el eje mayor algo inclinado hacia fuera. Por el lugar que ocupa el hígado, el riñón derecho se ve desplazado un poco más abajo que el izquierdo.
Estructura externa
Cada riñón está rodeado por una cápsula resistente de tejido fibroso blanquecino que se interrumpe a nivel del hilio renal, una concavidad situada en su borde interno, por la que penetran en el riñón el uréter y los vasos sanguíneos.
Aunque hay un gran número de variaciones individuales en la vascularización renal, cada riñón está irrigado por una arteria renal que se origina de la aorta y que, poco antes de llegar al hilio, se bifurca en sus ramas anterior y posterior. Las venas renales se sitúan por delante de las arterias y desembocan en la vena cava inferior.
Estructura interna
Al practicar la hemisección de los riñones a lo largo de su eje mayor, es posible observar que están formados por dos tipos de sustancia:
El seno renal es una cavidad cuya abertura coincide con el hilio renal y cuyas paredes están constituidas por el parénquima renal. Contiene, en un tejido celuloadiposo, las ramificaciones de los vasos, los nervios y los primeros segmentos del aparato excretor urinario: los cálices y la pelvis renal.
Anatomía microscópica
La nefrona es la unidad estructural y funcional del riñón y comprende un elemento filtrante (corpúsculo renal de Malpighi) y un túbulo renal.
Corpúsculo renal
El corpúsculo renal de Malpighi está compuesto por el glomérulo capilar y la cápsula de Bowman que lo recubre. Existe un espacio dentro de la cápsula, espacio de Bowman, hacia donde pasa el líquido filtrado procedente del glomérulo.
La barrera de filtración del corpúsculo renal o membrana glomerular consta de tres capas: el endotelio de los capilares glomerulares, la membrana basal y una capa de células epiteliales especializadas con fenestraciones.
Las células mesangiales se sitúan en la parte central del glomérulo entre las asas capilares, a veces penetrando en ellas de forma que conectan íntimamente con la célula endotelial. Estas células tienen función contráctil, gracias a los filamentos de actina y miosina, que les permiten regular el coeficiente de ultrafiltración en respuesta a distintos agonistas. Además, tienen capacidad fagocítica y pueden sintetizar y degradar la matriz extracelular. Intervienen también en la síntesis de determinados autacoides y factores de crecimiento que pueden actuar de forma autocrina y paracrina.
Túbulos renales
El túbulo renal comienza con el túbulo proximal que inicialmente forma varias espiras (túbulo contorneado proximal), seguida de una porción recta. El siguiente segmento es la rama delgada descendente del asa de Henle, que posee una morfología en horquilla, comenzando en su final con un ascenso paralelo a la rama descendente. En las asas largas, la primera porción de la zona ascendente permanece delgada, denominándose rama delgada ascendente del asa de Henle. Más allá de esta región, las asas largas se ensanchan en la rama ascendente gruesa del asa de Henle, en cuya parte final existe una zona engrosada denominada mácula densa, en la que el túbulo transcurre entre las arteriolas que irrigan su propio glomérulo. Tras ella comienza el túbulo contorneado distal que, a través de los conductos conectores, llega a los tubos colectores corticales que entran en la médula, convirtiéndose en tubos colectores medulares externos e internos. Estos últimos se unen a otros y todos los de una pirámide renal convergen para formar una estructura que desemboca en la papila renal en uno de los cálices menores.
Aparato yuxtaglomerular
Está situado entre la primera porción del túbulo contorneado distal y las arteriolas aferente y eferente, pertenecientes al corpúsculo renal de su propia nefrona. Lo componen tres tipos de células:
El corpúsculo renal y los túbulos contorneados se encuentran en la corteza renal; en cambio, el asa de Henle y la mayor parte de los túbulos colectores se sitúan en la médula renal.
Función renal
La función básica del riñón es la formación de orina para su eliminación a través del sistema excretor urinario. Dos procesos distintos determinan esta formación: la filtración de líquido a través de los capilares glomerulares hacia el espacio de Bowman y la modificación del volumen y de la composición del filtrado glomerular en los túbulos renales.
Filtrado glomerular
El líquido pasa de los capilares glomerulares a la cápsula de Bowman por la existencia de un gradiente de presión entre estas dos áreas. Este proceso está favorecido por dos características estructurales que convierten los corpúsculos renales en membranas de filtración especialmente eficaces:
En condiciones normales se producen 120 ml/minuto o 180 l/día de filtrado. La tasa de filtración glomerular está determinada, además de por la diferencia de presión en el capilar glomerular, por el flujo plasmático renal y por el coeficiente de ultrafiltración glomerular, dependiente del área de filtración y de la permeabilidad de la membrana a través de la que ésta se produce.
El grado de FG de un paciente depende del número de nefronas con capacidad de filtración.
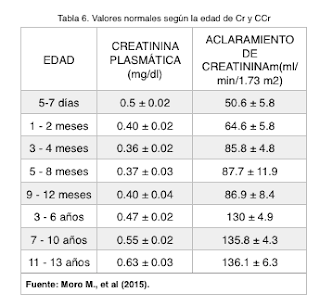
La nefrogénesis ocurre durante la vida intrauterina y se completa a las 36 semanas de gestación. Sin embargo, el grado de FG es bajo durante la vida fetal a consecuencia de un bajo flujo urinario y la creatinina no es un buen marcador del FG fetal porque cruza libremente la placenta y refleja tan solo la función renal materna. En el periodo posnatal existe una disminución fisiológica del FG: en recién nacidos, sus valores se sitúan alrededor de 20 ml/min/1,73 m2 y aumentan, progresivamente, hasta alcanzar las cifras de los adultos jóvenes (120-130 ml/min/1,73 m2) hacia los dos años de edad.
Función tubular renal
El ultrafiltrado glomerular es modificado en los túbulos renales por dos procesos: la reabsorción y la secreción tubulares.
En el túbulo proximal se reabsorben el 60-80% del agua y sodio filtrados, y prácticamente la totalidad de la glucosa, aminoácidos, proteínas de bajo peso molecular, potasio, bicarbonato, citrato, ácidos orgánicos y el fosfato.
La rama descendente del asa de Henle reabsorbe el 15% del agua filtrada mientras que en el asa ascendente, impermeable al agua, se reabsorbe el 25% del NaCl filtrado, cantidades elevadas de calcio y magnesio, y se secreta potasio.
Finalmente, en el túbulo distal se reabsorbe el 7% del agua, sodio y cloro, secretando potasio e hidrogeniones.
A nivel del túbulo colector cortical se regula la excreción final de agua por orina dependiendo del estado de hidratación y la acción de la hormona antidiurética (ADH).
El complejo equilibrio entre estos dos procesos, en ocasiones regulado por influjo hormonal, posibilita la formación de orina con unas características determinadas y mantiene estable la composición del medio interno. De esta forma, entre el 97 y el 99% del agua y una parte importante de los solutos filtrados en el glomérulo volverán a la sangre y no formarán parte de la orina
La función renal en el feto se caracteriza por una baja tasa de filtración glomerular determinada por una tensión arterial y un flujo plasmático renal bajos, un área de filtración menor y unas elevadas resistencias vasculares renales. Sin embargo, tras el nacimiento la función renal aumenta debido al ascenso de la tensión arterial y al importante descenso de las resistencias vasculares renales.
Regulación renal de la presión arterial
El riñón participa de manera importante en la regulación de la presión arterial merced a su acción sobre el equilibrio del Na+, un determinante importante de la presión arterial.
La concentración de Na+ en el líquido tubular proximal se percibe en la mácula densa, parte del aparato yuxtaglomerular. En este lugar se valora también la presión de perfusión de la sangre, un indicador importante del estado del volumen intravascular en circunstancias normales. La escasez del Na+ y la menor presión de perfusión actúan como un estímulo para la liberación de la renina. La renina, una proteasa elaborada en las células yuxtaglomerulares, escinde el angiotensinógeno sanguíneo para generar angiotensina I, transformada en angiotensina II por la enzima convertidora de angiotensina. La angiotensina II aumenta la presión arterial provocando vasoconstricción y estimulando la secreción de la aldosterona, que favorece la retención del Na+ y del agua en el túbulo colector.
La depleción del volumen intravascular también desencadena la liberación de vasopresina. Receptores en el cuerpo carotídeo y otros captan la disminución en la presión arterial y activan las vías neurales autónomas y la liberación de vasopresina en el hipotálamo. En la membrana plasmática apical del túbulo colector renal, la vasopresina facilita la inserción de canales para el agua, aumentando su cantidad y, por tanto, la reabsorción de agua libre y, secundariamente, la tensión arterial.
Los riñones también tienen la capacidad de producir mensajeros químicos, como las prostaglandinas, las quininas y el óxido nítrico que participan en mecanismos hipotensores.
Función endocrina
El riñón sintetiza dos hormonas; la eritropoyetina y el calcitriol o vitamina D activa.
La eritropoyetina es una glicoproteína, producida por un grupo especial de células del intersticio renal que se libera, principalmente, en respuesta a la hipoxia y estimula la eritropoyesis en la médula ósea. En algunas patologías renales, especialmente en la enfermedad renal crónica, se produce un déficit en la producción de esta hormona y consecuentemente se acompaña de anemia.
La vitamina D se forma a partir del 7-dehidrocolesterol que, por acción de la luz solar en la piel, se convierte en colecalciferol. Esta sustancia es hidroxilada en el hígado, convirtiéndose en 25-hidroxicolecalciferol, pero el metabolíto más activo, llamado 1,25 dihidroxicolecalciferol o calcitriol se forma tras sufrir una nueva hidroxilación en las células del túbulo renal. El calcitriol, que interviene de forma principal en el metabolismo óseo tiene, por tanto, origen renal. Su déficit explica, en parte, el hipocrecimiento y la osteodistrofia de la enfermedad renal crónica.
Glucogénesis
Finalmente, es preciso señalar que, en los periodos de ayuno prolongado, los riñones son capaces de sintetizar glucosa a partir de ciertos aminoácidos y otros precursores, liberándola a la sangre en cantidades que representan el 80% de la glucosa producida por el hígado.
Los uréteres (derecho e izquierdo) conectan con la vejiga (que es única), a la cual llegan por la cara posterior. Los uréteres son tubos estrechos que en la edad adulta, alcanzan una longitud de 25 a 30 cm, con un diámetro desde 1 a 10mm.
La vejiga urinaria es un órgano muscular hueco, distensible, situado en la cavidad pélvica. La forma depende de la cantidad de orina que contenga. En reposo y vacía, se colapsa; en caso de poca orina, adopta una forma esférica; cuando está llena adopta una forma de pera y se eleva en la cavidad abdominal. Su capacidad de almacenamiento de orina varía desde 700 ml a 800 ml. En su parte inferior posee el orificio uretral interno que es el origen de la uretra.
La uretra es un tubo conductor que va desde el orificio uretral interno hasta el meato externo u orificio uretral externo. En los varones en edad adulta, su longitud promedio es de 15 a 20cm, mientras que en las mujeres es de tan solo 4 cm. En ambos sexos la uretra es la porción terminal del sistema urinario y la vía de paso para expulsar orina del cuerpo.
La insuficiencia renal o fallo renal se produce cuando los riñones no son capaces de filtrar adecuadamente las toxinas y otras sustancias de desecho de la sangre.
La enfermedad renal varía con el tipo y la severidad de la anomalía. El conocimiento de antecedentes, presencia de signos y síntomas y la evaluación del riñón, que debe incluir tanto el estado morfológico como su capacidad funcional nos ayudarán en la valoración de la misma:
La insuficiencia o enfermedad renal se puede dividir en dos categorías:
Insuficiencia renal aguda (IRA)
Es un síndrome clínico y multietiológico caracterizado por una disminución brusca (horas o semanas) de la función renal y como consecuencia de ella, retención de productos nitrogenados (más especialmente creatinina plasmática) y alteraciones en la homeostasis hidroelectrolítica. Abarca desde muy sutiles alteraciones hidroelectrolíticas hasta la necesidad de terapia sustitutiva.
Es un grave problema a nivel mundial que afecta a una gran parte de pacientes hospitalizados por cualquier causa y que empeora su pronóstico.
Incidencia
El 10% de los niños hospitalizados por cualquier causa tiene algún grado de IRA. Este porcentaje aumenta en relación con la gravedad de la enfermedad de base siendo de hasta un 80% en los pacientes graves ingresados en Cuidados Intensivos.
La incidencia depende de la patología subyacente. En los niños que ingresan en Cuidados Intensivos, el riesgo de sufrir IRA aumenta un 5-10% respecto a la hospitalización general. Cuando se trata de trasplante de médula, el riesgo se multiplica por tres y en los que precisan ventilación mecánica o drogas vasoactivas por cinco.
La incidencia de IRA a nivel mundial en niños hospitalizados por cualquier causa y aplicando los criterios KDIGO se ha estimado en uno de cada tres con una mortalidad del 14%, siendo tanto la incidencia como la mortalidad mayores en países menos desarrollados.
Etiología
La IRA se produce cuando hay una agresión de factores externos que interaccionan con la respuesta individual con una susceptibilidad variable.
La etiología en los niños depende mucho de las patologías atendidas en cada hospital y en cada país. Hace unos años prevalecían las causas renales, con el síndrome hemolítico-urémico a la cabeza, como continúa siendo en los países en desarrollo. Actualmente, la etiología extrarrenal es la principal causa de IRA y depende del tipo de patología atendida o cirugías que se realizan en cada centro. Hasta un 80% de los niños que precisan tratamiento sustitutivo agudo tienen etiología extrarrenal.
En países desarrollados, las causas más frecuentes en niños son la cirugía cardíaca, las sepsis y los nefrotóxicos. Del 20 al 40% de las cirugías cardiacas en niños se complican con IRA y un tercio de los pacientes con sepsis también lo desarrollan constituyendo el 50% de todos los casos de IRA.
Otras patologías presentan IRA con gran frecuencia. Es el caso de los pacientes quemados ingresados en Cuidados Intensivos Pediátricos, de los que casi la mitad presenta IRA, hecho que produce un aumento de la mortalidad de forma independiente a su pronóstico de la quemadura.
Es muy importante establecer pronto la etiología de la IRA para iniciar tratamiento específico en los casos en que se pueda. Algunos biomarcadores podrían ayudar porque están más elevados en determinadas etiologías. El pronóstico depende de la situación basal del paciente a nivel general y renal, del agente desencadenante y de la duración del daño renal. Al valorar el riesgo individual de padecer IRA de cada paciente, podemos anticiparnos en su manejo e influir en su evolución, mejorando su pronóstico.
Las indicaciones clásicas del tratamiento sustitutivo en la IRA son los síntomas de uremia, sobrecarga de volumen y trastornos electrolíticos graves. Sin embargo, no existen evidencias sobre el momento ideal de inicio. El objetivo es mantener la homeostasis de líquidos y electrolitos, permitiendo la recuperación del daño renal y el tratamiento de soporte.
Su consecución, más que la sola valoración de las cifras de urea y Creatinina, debe orientar sobre el momento de inicio de la técnica de depuración. Previamente se debe sopesar los riesgos propios de la técnica, del acceso vascular y la anticoagulación.
Insuficiencia o enfermedad renal crónica (IRC) / (ERC)
Según las guías KDIGO la ERC se define como la presencia de alteraciones en la estructura o función renal durante al menos tres meses y con implicaciones para la salud, entre ellas:
Según las mismas guías, esta definición sería válida tanto para adultos como para niños, si bien en la edad pediátrica habría que tener en cuenta estos aspectos:
La ERC se clasifica en distintos estadíos según el grado de deterioro del filtrado glomerular:
Epidemiología
Existen pocos datos sobre la incidencia de ERC en la edad pediátrica y los que hay posiblemente subestiman los valores reales, ya que en muchos casos los estadios iniciales no se registran. Los registros europeos muestran incidencias alrededor de 10-12 pacientes por millón de población pediátrica (ppmp) y prevalencias alrededor de 59-74 ppmp.
El Registro Español Pediátrico de IRC no terminal (REPIR II), que recoge desde 2007 datos de niños <18 años con FG <90 ml/min/1,73 m2, en su análisis de 2011, encontró una prevalencia bastante mayor, de 128 pmpp, posiblemente por ser prácticamente el único registro que incluye los estadios más precoces.
La ERC es más frecuente en varones (63,3% REPIR II); en cuanto a la raza, en Norteamérica la incidencia es de dos a tres veces mayor en niños de raza afroamericana.
Las anomalías estructurales son la causa de más de la mitad de los casos de ERC en la infancia (57% en datos REPIR II) seguidas de las enfermedades renales quísticas y hereditarias (16%), las enfermedades vasculares (9,4%) y las glomerulopatías primarias o secundarias (5,1%).
Sintomatología
Las alteraciones producidas por la ERC son amplias:
En circunstancias normales más del 99% del sodio filtrado es reabsorbido a nivel tubular. La reabsorción en el túbulo proximal permanece bastante estable y el control es mantenido fundamentalmente en el túbulo distal hasta estadios finales de la ERC en los que se produce una retención de sodio (Na) y agua con sobrecarga de volumen; sin embargo, en los niños con patología estructural renal (uropatía obstructiva y displasia), incluso leves disminuciones del FG pueden acompañarse de una elevada pérdida de sodio y agua (por déficit de capacidad de concentración) que conducirá a una depleción intravascular.
Así mismo, en la ERC se produce un hiperaldosteronismo secundario que permite aumentar el intercambio Na-K a nivel de túbulo distal y colector, con lo cual la homeostasia del potasio se mantiene hasta las fases finales de la enfermedad; los niños con uropatía obstructiva pueden presentar un hipoaldosteronismo hiporreninémico o un pseudohipoaldosteronismo y desarrollar hiperpotasemia incluso con FG poco disminuido.
El objetivo del tratamiento será mantener un adecuado estado de hidratación con Na sérico en torno a 140 mEq/l, mantener cifra de K sérico entre 3,5 y 5,5 mEq/l y mantener bicarbonato sérico entre 22 y 24 mEq/l, mediante el aporte de suplementos de sal, calcio, uso de diuréticos, inhaladores de agonistas B-2 y /o glucosa con o sin insulina.
Se produce una disminución de la excreción de hidrogeniones y pérdida de bicarbonato. La acidosis aumenta el catabolismo, contribuye al hipocrecimiento y provoca la pérdida de calcio en el hueso. El hiperparatiroidismo, la ingesta elevada de proteínas animales y los estados catabólicos (malnutrición, infección...) contribuyen a la acidosis.
El objetivo del tratamiento será mantener el pH sanguíneo en límites normales con bicarbonato sérico entre 22 y 24 meq/l, mediante el aporte de bicarbonato sódico.
Es la concentración de hemoglobina (Hb) menor de 2 DE para la edad y el sexo. Hablaremos de anemia sí;
La anemia provoca disminución del aporte de oxígeno a los tejidos, altera la respuesta inmunitaria, contribuye al retraso de crecimiento y al retraso intelectual (en niños) y genera daño cardiaco entre otros efectos deletéreos.
El principal factor contribuyente a la anemia en la ERC es la disminución de la síntesis de eritropoyetina. Otros factores implicados son: déficit de hierro, déficit de vitamina B12 y ácido fólico, infección o inflamación crónica, hipotiroidismo, hiperparatiroidismo o pérdida crónica de sangre. Su frecuencia y severidad está en relación inversa al grado de función renal y suele aparecer a partir del estadio3.
Se deben realizar determinaciones periódicas de Hb en los niños con ERC, más frecuentes cuanto menor sea el FG. Se aconseja mantener la hemoglobina entre 11 y 12 g/dl.
Ante anemia con depósitos de hierro bajos (definidos como IST ≤20% y ferritina ≤100 mg/dl), se aconseja suplementación con hierro, inicialmente por vía oral si buena tolerancia digestiva, excepto en niños en tratamiento sustitutivo con hemodiálisis en los que se administra de forma intravenosa y semanal coincidiendo con la sesión de diálisis.
Una vez lograda una normalización del hierro y si persistiera la anemia, se iniciaría tratamiento con agentes estimulantes de la eritropoyesis (AEE) por vía subcutánea o por vía intravenosa en pacientes en diálisis.
Conforme el FG disminuye, se produce un progresivo deterioro de la homeostasis mineral, con alteraciones en los niveles séricos y tisulares de calcio (Ca) y fósforo (P), así como de parathormona (PTH), 25 y 1,25(OH) vitamina D (vitD), FGF-23 (Fibroblast Growth Factor 23) y de la hormona de crecimiento. Todo ello provoca alteraciones esqueléticas y cardiovasculares.
El objetivo es, conseguir una tasa normal de formación y remodelado óseo y evitar complicaciones vasculares. El tratamiento debe está enfocado al control del Ca, P, producto Ca-P, Vit D y PTH, mediante aportes de calcio, Vit D, restricciones de P y administración de quelantes e incluso tratamiento quirúrgico en caso de resistencia al tratamiento o en deformidades óseas.
Valores normales de fósforo, calcio y fostatasa alcalina:
No existen datos claros acerca de la prevalencia de malnutrición en el niño con ERC, pero ésta aumenta cuanto más grave es la afectación renal y menor es la edad.
Así, en el análisis realizado por el REPIR II en 2011, un 29% de los menores de dos años tenía un índice de masa corporal (IMC) <-1,88 DE. En este grupo de edad, además, una adecuada nutrición es crucial para el crecimiento y el neurodesarrollo.
Por otro lado, el aumento de incidencia de obesidad y sobrepeso en la población infantil en general también afecta a los niños con ERC con clara repercusión sobre la evolución renal. La malnutrición va a ser uno de los factores que más va a condicionar el aumento de morbi-mortalidad en los niños con ERC.
Anorexia: La ingesta espontánea está disminuida, en mayor grado cuanto más grave es la ERC, pero puede aparecer aún con FG relativamente altos. En ella influyen alteraciones en el gusto, un vaciado gástrico lento o el acúmulo de hormonas saciantes como la leptina o la grelina.
Una situación especial es la de los lactantes con alteraciones estructurales e insuficiencia renal poliúrica con pérdida salina. En estos niños, a la anorexia inducida por la ERC se unen la necesidad de beber grandes cantidades de líquido y la pérdida salina, que si no se repone, induce una situación de deshidratación crónica. En estos niños, además del aporte nutricional, se necesita un balance positivo de sodio para conseguir una adecuada ganancia de peso y talla.
Objetivos:
Las guías KDOQI recomiendan evaluar los parámetros nutricionales con una frecuencia al menos el doble de lo recomendado en el niño sano de la misma edad y con mayor frecuencia en la IRC avanzada. Esa evaluación debe incluir el peso, la talla, el perímetro cefálico, el cálculo de índices nutricionales y una revisión de la dieta como puntos imprescindibles. De una manera ideal todo niño, sobre todo lactante, con una disminución severa del FG debería ser controlado por un nutricionista infantil.
Tratamiento dietético
Las guías KDOQI recomiendan un aporte proteico del 100-120% de las RDI en niños con IRC excepto en los casos de diálisis peritoneal o hemodiálisis en los que se requiere un suplemento proteico. Aunque en adultos hay datos que muestran un efecto beneficioso de dietas bajas en proteínas sobre la progresión de la ERC, en niños este efecto no está demostrado y una restricción importante implica un riesgo de malnutrición.
Según las guías KDOQI, el aporte calórico en niños con ERC es el 100% de las RDI. Es fundamental asegurar de manera paralela el aporte proteico y calórico adecuado para permitir el máximo aprovechamiento de las proteínas sin un aumento de urea. Las necesidades pueden aumentar en la recuperación de una enfermedad aguda.
En el RN y en el lactante, siempre que se pueda se intentará mantener la lactancia materna. Si hay que usar una leche de continuación se elegirá aquella que más se adapte a las necesidades del niño. Existen leches pobres en potasio y en fósforo que permiten disminuir su aporte en los lactantes con ERC grave, manteniendo un adecuado aporte proteico y calórico.
La diversificación se hará al ritmo normal del lactante sano. Tan solo en lactantes con ERC grave puede ser necesarios cambios en esa diversificación para poder asegurar el aporte calórico y controlar la sobrecarga de potasio y fósforo.
En los niños mayores se debe intentar al máximo ajustar la alimentación a las características culturales, sociales y económicas de la familia. Es importante prevenir fobias y evitar la alimentación forzosa para evitar relaciones anómalas con la comida.
Intervención nutricional
Según las guías KDOQI se requerirá una intervención nutricional cuando haya constancia de ingesta inadecuada, cuando haya una pérdida de peso de > 10%, cuando el IMC sea >p85 o
Inicialmente se administrarán suplementos por vía oral, pero en el caso de los lactantes y niños menores de dos años la malnutrición puede condicionar un retraso en el crecimiento y en el desarrollo que no va a ser recuperable por lo que, sobre todo en los casos más graves, debe plantearse de modo muy precoz la nutrición enteral forzada, por SNG o gastrostomía.
En los mayores de tres años, la nutrición enteral forzada tiene menos indicaciones ya que su ingesta espontánea es mayor y suele bastar con suplementos nutricionales. En estas edades una nutrición forzada solo estará indicada para corregir la malnutrición, no para mejorar el crecimiento que depende más de la GH.
El hipocrecimiento en la ERC es un fenómeno complejo con muchos factores implicados.
Las anomalías en el eje GH-IGF-I presentes en ERC constituyen el factor clave en niños mayores de dos años de edad. La administración exógena de hormona de crecimiento recombinante humana (rhGH) permite corregirlo y alcanzar y mantener una talla normal (idealmente el percentil 50 o la talla media parental). Los criterios que un paciente con ERC debe cumplir para recibir tratamiento con rhGH son:
Antes de iniciar el tratamiento y durante el mismo será necesaria una evaluación y unos controles periódicos tanto para evaluar respuesta como para detectar la aparición de posibles efectos secundarios:
El tratamiento debe suspenderse en los siguientes casos:
En los casos de respuesta insuficiente, es decir, si tras un año de administración el crecimiento no supera en al menos 2 cm el del año pre-inicio de administración de rhGH y una vez optimizados todos los factores que podrían interferir con su actuación, está indicado suspender el tratamiento y valorar remitir a estudio por endocrinología para descartar otras causas de hipocrecimiento.
Tratamiento
Los objetivos principales del tratamiento son:
Cuando ya no es posible el tratamiento conservador de dicha situación se iniciaría la terapia renal sustitutiva (TRS). Está compuesta por; hemodiálisis, diálisis peritoneal y trasplante, siendo el trasplante renal (TR) el tratamiento sustitutivo de elección en el niño con ERC, el que proporciona mejor calidad y expectativa de vida.
La diálisis el tratamiento de mantenimiento que le permite la espera hasta recibir un órgano si sus condiciones clínicas y analíticas no permiten que continúe solo con tratamiento conservador. No hay estudios comparativos que hayan apoyado de forma absoluta la elección de uno u otro método de diálisis: diálisis peritoneal o hemodiálisis, contribuyendo a su elección múltiples factores (edad, localización geográfica, médicos, composición familiar, soporte social, cumplimiento del tratamiento, función residual...). El trasplante renal es la única modalidad de tratamiento sustitutivo que rehabilita totalmente al niño con enfermedad renal terminal.
La tasa de supervivencia a largo plazo de niños con TRS ha mejorado de manera sustancial. Esto podría explicarse por la tendencia creciente a incluir en programas de TRS a pacientes muy pequeños, lactantes y neonatos, así como a niños con comorbilidad no renal (síndromes multisistémicos, enfermedades metabólicas o neoplasias).
Hay una tasa de mortalidad significativamente mayor en niños muy pequeños, identificando claramente la edad como factor de riesgo. El avance de las técnicas de diálisis y de otros cuidados de la IRC está permitiendo a niños muy pequeños alcanzar el crecimiento necesario para recibir un trasplante.
La hemodiálisis es una alternativa indispensable para el tratamiento de la enfermedad renal crónica avanzada en niños.
La diálisis es el proceso físico-químico mediante el cual se produce un intercambio molecular entre dos soluciones separadas por una membrana semipermeable.
El comportamiento del agua, iones y otras moléculas a través de un sistema integrado por una membrana semipermeable, un compartimiento hemático y un baño de diálisis depende de dos diferentes propiedades:
En la hemodiálisis, la membrana del dializador permite el transporte bidireccional de agua y moléculas de pequeño y mediano peso molecular (menores de 50 000 Dalton), pero impide el paso de pequeñas proteínas como la albúmina (70 000 Dalton) o elementos formes. La práctica clínica ha hecho que diferenciemos dos modalidades de tratamiento en función de la preponderancia del fenómeno difusivo:
El aclaramiento de un soluto (KD) se expresa como la cantidad de sangre totalmente depurada del mismo en una unidad de tiempo (habitualmente ml/min) y depende del KOA del dializador, del flujo sanguíneo (QB) y del flujo del baño de diálisis (QD). Este concepto es virtual puesto que lo que realmente apreciamos es la disminución de la concentración del soluto. Considerando al individuo con un volumen de distribución uniforme, la fracción del soluto que permanece en la sangre en un tiempo determinado la podemos averiguar mediante la siguiente fórmula:
Ct / Ci = e-Kt/V
Donde Ct es la concentración del soluto en un tiempo t y Ci es la concentración inicial del mismo. Esta fórmula implica una tasa de desaparición del soluto de un modo logarítmico y la eficacia de la diálisis puede ser hallada según la fórmula:
Kt/V = Ln [Ct/Ci]
Donde K es el aclaramiento de urea para el dializador (litros/h), t el tiempo de duración de la sesión de HD (h) y V el volumen de distribución de la urea (equivalente al volumen plasmático, en litros).
En la práctica clínica diaria Kt/V y dosis de diálisis tienen el mismo significado, volumen de plasma aclarado de urea respecto al volumen total de plasma del organismo, y un valor de 1 expresaría, en teoría, un aclaramiento de todo el volumen plasmático (diálisis perfecta).
La prescripción de HD se realiza sobre la base de criterios de Kt/V de urea, si bien, para el cálculo exacto del fenómeno depurativo hay que tener en cuenta el proceso convectivo o eliminación del soluto asociado a la ultrafiltración, así como, la existencia de una distribución no uniforme de solutos por lo que para el cálculo de la dosis de diálisis son necesarias fórmulas más complejas.
BUN: Nitrógeno ureico.
Indicaciones y contraindicaciones de la hemodiálisis pediátrica:
En general, las limitaciones de la HD están relacionadas con la dificultad para la obtención de un acceso vascular o con la intolerancia a cambios rápidos del volumen plasmático, lo que es especialmente importante en lactantes o niños pequeños que deberán ser tratados preferentemente con diálisis peritoneal.
Por otro lado, la HD se prefiere como técnica de depuración crónica en niños con malformaciones que afecten a la pared abdominal o requieran derivaciones intestinales o cirugía abdominal reiterada; también en procesos como hernias diafragmáticas congénitas o enfermedad pulmonar grave. Además, está indicada siempre que exista incapacidad difusiva o de ultrafiltración del peritoneo.
|
Contraindicaciones absolutas |
Contraindicaciones relativas |
|
Pacientes muy pequeños |
Hipertensión mal controlada |
|
Falta de acceso vascular |
Cardiomiopatía hipertensiva |
|
Contraindicaciones para anticoagulación |
Lejanía a centros pediátricos |
|
Inestabilidad cardiovascular |
|
Accesos vasculares en niños
El éxito de un programa de hemodiálisis en niños depende de un acceso vascular adecuado.
Actualmente, según datos del Registro Español Pediátrico de Insuficiencia Renal Terminal, el 92% de los niños en HD prolongada realizan su tratamiento a través de un catéter venoso central de doble luz (en neonatos y lactantes pequeños de una luz), tunelizado, con cuff subcutáneo y colocado preferentemente en la vena yugular interna derecha (por conseguirse mayor flujo sanguíneo que en la izquierda), con la punta situada en la unión cava-aurícula o en la aurícula derecha. Son preferibles los de silicona a los de poliuretano y los hay de distintos tamaños y diámetros para su uso según el tamaño del paciente. La mayoría pueden permanecer colocados durante varios meses. En la elección del catéter como acceso vascular en la infancia influyen dos factores:
Ambos han determinado el abandono de dichas fístulas como acceso permanente en la población pediátrica española.
|
Neonato-6 kg:………6,5 Fr (1 luz o 2 luces) 6-15 kg:……………..8 Fr 15-30 kg:……………9 Fr Más de 30 kg:……….≥10 Fr
|
Equipos de diálisis pediátrica; dializadores, líneas y monitores
El dializador es el elemento básico del tratamiento con hemodiálisis. Hay tres características del mismo que determinan su rendimiento (eficacia con que purifica la sangre) y biocompatibilidad (propiedad por la que, al contacto con la sangre, no provoca reacciones adversas clínicamente importantes).
La membrana es el componente esencial del dializador; según el tipo, posee diferente capacidad de ultrafiltración (KUF) y depuración (KOA), influyendo el espesor de la misma y el área de superficie como determinantes más importantes de la eliminación difusiva de solutos. Actualmente se utilizan fundamentalmente de dos clases: membranas derivadas de la celulosa modificada y membranas sintéticas; estas últimas tienen distintas composiciones químicas (copolímeros) y pueden ser de alto o bajo flujo según su mayor o menor permeabilidad hidráulica por cada unidad de presión aplicada.
Los dializadores actuales utilizados en pediatría son dializadores capilares, en los que la sangre fluye a través de fibras huecas de membranas semipermeables, en tanto que el líquido de diálisis fluye alrededor y generalmente en sentido inverso. El número y longitud de estas fibras proporciona la superficie total de membrana del dializador requiriendo un volumen de sangre determinado para su cebado que habrá que tener en cuenta según el tamaño del niño al prescribir la hemodiálisis.
Es de gran importancia que el dializador sea y se mantenga estéril, dado su contacto directo con la sangre.
Las líneas del circuito de sangre deben cumplir las siguientes características:
Es un sistema integrado que consta de mezclador de concentrado de baño de diálisis con agua tratada (34 litros de agua por cada litro de concentrado) y de control de flujo hemático.
La sangre y el baño son impulsados hacia el dializador mediante rodillos o bombas. La bomba de sangre crea una presión negativa en la línea arterial y transforma esta presión en positiva para impulsar la sangre, tras pasar por el dializador, a través de la línea venosa de regreso al paciente. El monitor controla la composición, temperatura y flujo de sangre y baño de diálisis en el dializador, así como, la ultrafiltración programada.
Los monitores utilizados en pediatría son esencialmente los mismos que en los adultos, a los que se ha incorporado un software pediátrico. Además de los controles de seguridad obligatorios (fugas de aire y sangre, temperatura, control de ultrafiltración y conductividad), los monitores modernos incorporan módulos capaces de medir en tiempo real cambios en el volumen plasmático del paciente, recirculación y dializancia lo que permiten obtener cálculos muy aproximados de la dosis de diálisis durante la sesión y poder modificar la programación inicial según los cambios obtenidos, así como, ajustar la ultrafiltración a los cambios de volumen plasmático del paciente.
Tradicionalmente, la hemodiálisis hospitalaria en niños y adolescentes se ha asociado por una parte con problemas físicos, tales como alteraciones de crecimiento, nutrición y desarrollo, alteraciones óseas y vasculares y por otra de calidad de vida: procedimientos invasivos, hospitalizaciones, separación de los padres y de su ambiente familiar, limitaciones escolares, sensación de pérdida de la independencia y de la identidad e integridad corporal, así como, disminución en participación en actividades recreativas y asunción de responsabilidades. Las nuevas modalidades de tratamiento con hemodiálisis han acabado prácticamente con los problemas físicos, mientras que tan solo la hemodiálisis domiciliaria y las nuevas unidades infantiles hospitalarias con dotación social y escolar mitigan en alguna medida las de calidad de vida y limitaciones sociales.
Características de la unidad de diálisis pediátrica
Las Unidades de Diálisis Infantiles deberían estar situadas en hospitales con especialidades pediátricas, siendo muy importantes las de Neonatología, Nutrición, Cuidados Intensivos, Cardiología, Psiquiatría, Radiología intervencionista, Cirugía y Urología Pediátricas.
Lo ideal es que el hospital sea trasplantador, pero en caso que no lo fuere debería estar estrechamente conectado con el de referencia, estando los pacientes incluidos en lista de espera o programados para recibir trasplante de vivo salvo contraindicaciones. Asimismo, la Unidad de Diálisis Infantil debe contar con enfermería especializada y apoyo de psicólogos, maestros, pedagogos y grupos de voluntarios. Las unidades deben ser de puertas abiertas para padres y familiares y estar integradas en un proyecto escolar docente.
Prescripción de la sesión de hemodiálisis
Una sesión de diálisis individualizada es esencial para el control adecuado del paciente. La prescripción de las sesiones de diálisis se basa en la optimización de los siguientes criterios:
Para ello debemos considerar la modalidad y frecuencia de las sesiones y ajustar el tratamiento a las necesidades del paciente teniendo en cuenta la ganancia de peso y talla y el cambio constante de la composición corporal.
Hay estudios en niños que señalan algunas ventajas de la hemodiálisis convectiva (HDFOL) frente a la difusiva (hemodiálisis convencional) en términos de crecimiento. Sin embargo, hay dos factores importantes que sí pueden modificar la tolerancia al tratamiento y mejorar el crecimiento y la nutrición:
Anticoagulación
Cada vez es menos frecuente la administración de heparina sódica horaria o en bomba de infusión que ha sido sustituida por heparinas de bajo peso molecular (HBPM) que tienen la ventaja de poseer una mayor biocompatibilidad, no alterar los tiempos de coagulación y disminuir el riesgo de sangrado. Sus principales desventajas radican en la permanencia del efecto anticoagulante una vez finalizada la sesión de diálisis y el mayor coste económico.
Aunque no está recomendado sistemáticamente, en algunos pacientes con hemodiálisis diaria en el que las dosis acumuladas de HBPM puede inducir riesgo de hemorragia por acumulación se puede determinar actividad antifactor Xa con objeto de dosificar las heparinizaciones sucesivas.
Sellado y cuidado del catéter
La casi sistemática utilización del catéter central como acceso vascular en niños deriva en una atención específica que incluye vigilancia del aspecto del orificio de salida, control bacteriológico del mismo, cura diaria o semanal, según el estado, y finalmente sellado de las luces con citrato, heparina o uroquinasa.
Nutrición
Los requerimientos nutricionales mínimos son el 100% de los estimados para la edad del niño, ajustados a su actividad física y tamaño corporal (índice de masa corporal [IMC]), valorando su ajuste según la respuesta en ganancia o pérdida de peso, y manteniendo una distribución adecuada de principios inmediatos. Además, teniendo en cuenta que hay cierta pérdida proteica y de aminoácidos en cada sesión de hemodiálisis, la ingesta proteica debe incrementarse en 0,1 g/kg/d sumado a la ingesta proteica recomendada según la edad.
Con frecuencia, sobre todo en lactantes y niños de corta edad, el estado de hiporexia por la insuficiencia renal hace necesario el empleo de sonda nasogástrica o de gastrostomía para asegurar la consecución de estos requerimientos. La diálisis diaria mejora la nutrición.
Crecimiento
La HD frecuente, con un aumento del número de sesiones semanales, mejora, junto con la nutrición, la velocidad de crecimiento. El efecto es sumatorio al de la hormona de crecimiento (rHGH), indicada cuando la talla del niño se sitúe por debajo de -2 desviaciones estándar (DE) de talla para la edad y sexo, o la velocidad de crecimiento sea inferior también a -2 DE.
Antes de su administración, deben corregirse otros factores desencadenantes: malnutrición, acidosis, hiperfosfatemia e hiperparatiroidismo.
Anemia
En general, podríamos fijar los niveles diana de hemoglobina entre 11 y 12 g/dl, con objetivos de ferritina sérica en torno a 100-500 mg/ml e índice de saturación de la transferrina superior al 20%. Para ello se administra hierro oral o IV y, una vez conseguidos niveles correctos de hierro, asociamos al tratamiento eritropoyetina alfa, beta o darbepoetina, administrada generalmente por vía intravenosa al finalizar la sesión de hemodiálisis. La corrección de la anemia mejora el riesgo cardiovascular, así como, la actividad física, la función cardíaca, el apetito, la asistencia escolar y la calidad de vida.
Alteraciones del metabolismo óseo y mineral
Mantener unos niveles de calcio y de fósforo normales es una de las metas de la HD crónica. Se puede individualizar la concentración de calcio en el baño de diálisis según las necesidades. El incremento del número y/o la duración de las sesiones de HD tienen efectos positivos sobre el aclaramiento de fosfato, permitiendo en ocasiones la no necesidad de tratamiento con quelantes.
La siguiente tabla, muestra los niveles recomendados en niños en diálisis de los agentes que intervienen en la mineralización ósea:
Complicaciones durante la sesión de hemodiálisis
Hipotensión
Es la complicación más frecuente. Las manifestaciones clínicas pueden ser difíciles de valorar en lactantes por lo que se recomienda la monitorización de la presión arterial y la frecuencia cardiaca (pulsioxímetro) de forma continua, ya que el aumento de esta última suele preceder al accidente hipotensor. Aunque su etiología es generalmente multifactorial, debe intentarse un diagnóstico y tratamiento causal; no obstante, en el episodio agudo el tratamiento se realiza colocando al paciente en posición de Trendelemburg y administrando bolos de suero salino 1 molar de 0,5 a 2 mEq/kg en la cámara venosa. Durante la hipotensión la ultrafiltración debe interrumpirse. Puede emplearse manitol preventivo o ultrafiltración aislada si la ganancia ponderal excede del 5% del peso seco.
Hipotermia.
La mayor superficie corporal con relación al peso, los flujos sanguíneos relativamente bajos y la ultrafiltración aislada son factores de riesgo de hipotermia. Se debe elevar la temperatura del baño o realizar ultrafiltración aislada tan solo en periodos cortos de tiempo.
Síndrome de desequilibrio
El cambio osmolar rápido que acompaña a las primeras sesiones puede producir este síndrome neurológico caracterizado por nauseas, vómitos, cefalea, hipertensión y convulsiones.
Para minimizar el riesgo, durante las primeras sesiones de diálisis y en pacientes con valores de nitrógeno ureico superiores a 100 mg/dl, se recomiendan aclaramientos de 1,5 a 2 ml/kg (Kt/V de BUN por sesión de 0,6 a 0,8) y la administración preventiva de manitol a 0,5 g/kg.
Complicaciones del catéter
La utilización casi sistemática de catéteres como acceso vascular en niños ha favorecido la observación de complicaciones infecciosas y no infecciosas. La vigilancia, cuidado y sellado de los mismos por personal especializado disminuye la tasa de complicaciones. Las más frecuentes son: la infección del orificio de salida, la bacteriemia dependiente del catéter, la obstrucción parcial o total de una o dos luces del acceso, la extrusión parcial o total, la trombosis venosa y las arritmias. Cada complicación tiene un tratamiento específico que va desde la antibioterapia local o sistémica, la administración de uroquinasa intraluminal, la heparinización sistémica y/o la retirada y sustitución del acceso vascular.
Trasplante en pacientes en hemodiálisis
La decisión de dializar a un paciente en el periodo inmediato anterior a un trasplante depende del tiempo transcurrido desde la diálisis previa, el estado de hidratación y los niveles de electrolitos, fundamentalmente potasio.
En pacientes bien dializados, una sesión preoperatoria para retirar líquido es generalmente innecesaria, siendo incluso beneficioso el que estén ligeramente por encima de su peso seco para facilitar la diuresis postoperatoria. Si no obstante, se considera necesaria, una HD corta, de una a dos horas, puede ser suficiente para corregir los valores de potasio y optimizar el estado hemodinámico.
La diálisis peritoneal (DP) es una técnica sencilla, segura y de fácil aprendizaje para el tratamiento de la enfermedad renal crónica (ERC) a cualquier edad. Sin embargo, el trasplante renal anticipado es el tratamiento de elección en la ERC terminal del niño y adolescente. Hay que tener en cuenta que todos los pacientes pediátricos deben tener expectativas de trasplante renal cuando inician cualquier modalidad de diálisis. Cuando hay que demorar el trasplante por diversas circunstancias, la DP es una elección útil y satisfactoria para alcanzar un correcto control metabólico y nutricional.
Las ventajas de la DP sobre la hemodiálisis (HD) en la infancia derivan de su condición de técnica domiciliaria. Ofrece beneficios de una menor estancia hospitalaria y la oportunidad de que el niño asista al colegio e incluso sus padres a su actividad laboral, normalizando de este modo la dinámica familiar y mejorando la calidad de vida. Además se evitan las punciones del acceso vascular, dificultosas por la singularidad del árbol vascular infantil, si bien los pacientes que precisan periodos cortos de diálisis, son hemodializados a través de un catéter venoso central.
Una de las conocidas fortalezas de la DP es la estabilidad hemodinámica. La ultrafiltración (UF) constante y la estabilidad del volumen plasmático consiguen un mejor control de la presión arterial (PA). Se ha descrito una preservación más prolongada de la función renal residual (FRR) y por consiguiente permite menor restricción de líquidos. Estas ventajas influyen en la calidad de vida y en la morbimortalidad, ya que la hipertensión arterial (HTA) en niños en diálisis es un fuerte marcador de morbimortalidad.
En relación con la nutrición y el crecimiento, la DP permite menores restricciones dietéticas y además se ha publicado menor pérdida de talla al comparar con la HD.
Constituye en nuestro medio una técnica con baja mortalidad e indicación primordial en lactantes y niños muy pequeños como primer tratamiento sustitutivo antes del trasplante.
Fundamento de la diálisis peritoneal
La diálisis peritoneal consiste en la infusión de una solución en la cavidad peritoneal. Tras un periodo de intercambio, se produce la transferencia de agua y solutos entre la sangre y la solución de diálisis. Se realizará entonces el drenaje del fluido parcialmente equilibrado y la repetición de este proceso conseguirá remover el exceso de líquido y aclarar los productos de desecho y toxinas acumulados en el organismo, así como acercar los niveles de electrolitos a la normalidad.
El intercambio de solutos y fluidos se produce entre la sangre de los capilares peritoneales y la solución de DP. Los solutos de bajo peso molecular se transfieren por difusión, bajo un gradiente de concentración, o por convección, acompañando al transporte de agua. La ultrafiltración o movimiento de fluidos, ocurre a través de poros pequeños (40-50 Ả) y de las acuaporinas 1, estando determinada por la presión osmótica facilitada por el agente osmótico (generalmente la glucosa) del dializado y la presión hidráulica determinada por la presión intraperitoneal. Esta última, dependerá del volumen del intercambio y de la postura del paciente.
Indicaciones. Contraindicaciones. Elección de la técnica:
Indicaciones:
Contraindicaciones absolutas (son pocas) y se limitan a:
Contraindicaciones relativas:
Situaciones de riesgo:
Es muy importante recordar que la realización de gastrostomía, indicada en niños en IRC con necesidades nutritivas elevadas y con incapacidad de ingesta oral, debe realizarse preferentemente con anterioridad a la implantación del catéter de diálisis peritoneal, para evitar la extravasación del contenido gástrico con riesgo de peritonitis. En pacientes que ya han iniciado la DP, se recomienda implantar la sonda de gastrostomía por procedimiento quirúrgico abierto, que disminuye la posibilidad de contaminación de la cavidad peritoneal, asegurando las suturas del estómago y la pared abdominal. Se recomienda la administración de profilaxis antibiótica y antifúngica con fluconazol e interrumpir la diálisis peritoneal durante 4-5 días tras la implantación de sonda de gastrostomía, iniciándola después con volúmenes reducidos.
Elección de la técnica
Debemos siempre que sea posible ofrecer los dos tipos de diálisis, DP y hemodiálisis, si bien interesa resaltar el desconocimiento generalizado en la población de la DP. El médico debe facilitar de forma sencilla el conocimiento de las técnicas, ofrecer información detallada sobre la supervivencia y la calidad de vida, contrarrestar los temores con datos y apoyar a la familia, ya que en el caso de la DP pediátrica se trata de una técnica que requiere del esfuerzo parental.
Catéter
Tipos de catéter:
El catéter más utilizado es el Tenckhoff, de silicona, recto o curvo, o con punta en espiral, con uno o dos manguitos de dacrón para facilitar su anclaje. Existen catéteres de 31 cm para neonatos y lactantes, y de 37 cm y 39 cm para niños mayores.
Implantación del catéter:
Programar la inserción anticipada para permitir un periodo de reposo hasta su uso y conseguir una correcta cicatrización (entre 2-3 semanas). En niños se recomienda la implantación quirúrgica con anestesia general. En el preoperatorio, investigar portadores nasales de Staphylococcus aureus en todos los miembros de la familia, prescribir enemas sin fosfatos, y profilaxis antibiótica preinserción con Teicoplanina IV, 10 mg/kg (dosis máxima 400 mg) o vancomicina IV, 15-20 mg/kg. Es recomendable la omentectomía para evitar atrapamientos, con hemostasia cuidadosa. Las suturas deben quedar muy herméticas, comprobando el funcionamiento del catéter en quirófano. En el postoperatorio hay que extremar las medidas de inmovilización de catéter. Comenzar con lavados una o dos veces por semana con 10 ml/kg de solución de diálisis.
Dejar cebado con heparina y cerrado. Si hemoperitoneo, se efectuarán lavados diarios hasta obtener un drenaje claro.
Actualmente el catéter se coloca infraumbilical y en la región paramediana atravesando el músculo recto abdominal, donde el grosor del músculo puede envolver el maguito interno y facilitar su incorporación en la pared abdominal, evitándose la línea alba. Antes se hacía en la línea media, pero esta zona se ha abandonado prácticamente dada la gran cantidad de casos con fuga de líquido peritoneal precoz o formación de hernias, dada la escasa vascularización de la zona y la menor resistencia de la pared abdominal.
La punta del catéter de la porción intraperitoneal se dirige hacia abajo al cuadrante inferior izquierdo, donde el peristaltismo del colon descendente ayuda a evitar la migración del catéter.
Los manguitos de Dacron se colocan y se fijan, él más interno inmediatamente después del peritoneo, y el más externo en el tejido celular subcutáneo, aproximadamente a 2 o 3 cm. de la salida al exterior.
Todas las curas de la inserción del catéter, se realizaran con mascarilla, guantes y campos estériles, con suero fisiológico y Yodo Povidona u otro antiséptico (compatible con el material del catéter), frotando suavemente con una gasa estéril, hasta la curación total de la herida y siempre que el paciente presente signos de infección de la inserción. En caso de sangrado o fuga de líquido por la herida operatoria o la inserción, el apósito se levantara antes, para examinar la herida. El vendaje siempre debe ser levantado SUAVEMENTE para evitar tracciones o retorcimientos del catéter. Si el apósito estuviera muy adherido, se reblandecerá con suero fisiológico antes de levantarlo. Si retiramos enérgicamente un apósito que este pegado a una costra, romperemos la capa epidérmica y deberá formarse una nueva postilla, por lo que la reepitelizacíon se prolongara.
A partir de la colocación, semanalmente se curara y revisara la inserción, hasta conseguir una cura completa del proceso, cosa que sucede en cuatro u ocho semanas (el dato fundamental de curación se produce cuando la epidermis cubre al menos la mitad del área de implantación). En estas revisiones, se probara el funcionamiento del catéter con volúmenes pequeños para asegurarnos su viabilidad. Pasado más de una semana se procede a quitar los puntos de la herida operatoria.
Tras la colocación del catéter, el paciente permanecerá ingresado durante 48 horas, para observación fundamentalmente de la movilidad intestinal y del estado de la herida quirúrgica
Cuando el paciente se da alta, haremos hincapié en:
Complicaciones post colocación
La hemorragia puede ocurrir al pinchar la pared abdominal, la más espectacular sería al pinchar la arterial epigástrica.
Los primeros lavados tras implantación pueden salir sanguinolentos que se irán aclarando. En el túnel subcutáneo se puede producir sangrado en sábana que puede originar hematoma y a veces sangrado por el orificio, si la hemostasia durante la colocación no se ha realizado correctamente.
La perforación de una víscera con los nuevos trocares es difícil y generalmente es debido a adherencias de la víscera o por pegamientos a peritoneo parietal. Se diagnosticará porque el paciente sentirá más dolor, tras la infusión tendrá diarrea acuosa y el líquido drenado tendrá restos intestinales.
Cuando esto ocurre, se retirará el catéter y se esperará 24-48 h. para cerrarse la punción intestinal. Obviamente si hay hemorragia profusa habrá que hacer laparotomía de urgencia.
La obstrucción del catéter se debe a varias causas: Coágulos de fibrina, Estreñimiento, Atrapamientos por el epiplón, Migración del catéter, Acodamientos del catéter.
La obstrucción por coágulos de fibrina se resolverá con lavados peritoneales con heparina. Si no se resuelve se puede administrar Urokinasa.
Generalmente los coágulos de fibrina se deben a la demora de los lavados peritoneales. Ante esta situación la cavidad peritoneal se queda sin líquido y la fibrina de la trasudación se concentra y se coagula, obstruyendo la luz del catéter.
A veces el intestino se mueve menos por distintos motivos y los fecalomas desplazan o distorsionan los catéteres intraperitoneales dificultando su buen funcionamiento.
La mayoría de las veces este problema se resuelve con laxantes que no produzcan movimientos peristálticos bruscos y enemas, incluso algunos desplazamientos de la punta del catéter se puede solucionar de esta manera.
El atrapamiento por el epiplón impide el drenaje del catéter y la mayoría de las veces desplaza al catéter. A veces impide incluso la infusión del líquido peritoneal. El atrapamiento por el epiplón necesita omentectomía mediante laparoscopia o retirada del catéter. Los acodamientos del catéter se resolverán con cirugía recolocadora.
Las fugas del líquido peritoneal están relacionadas con el método de implantación, como puede ocurrir al no dar suturas alrededor del catéter en la pared muscular, no quedando fijo así el manguito en pared muscular y no guardar el periodo de descanso 15-30 días post implantación del catéter.
Se manifiesta tras golpes de tos, esfuerzos que aumenten la presión hidráulica intraabdominal. Habrá una caída de la ultrafiltración y aparecerá edema en la pared abdominal, que tomará un aspecto de piel de naranja y sensación de esponja al tacto.
El orificio de salida del catéter estará húmedo o saldrá un líquido que contendrá mucha glucosa. En muchos casos se resuelve suspendiendo la diálisis peritoneal dos semanas y en otros habrá que recolocar el catéter o dar nuevas suturas. También hay que tener en cuenta los factores predisponentes: Atrofia muscular de la piel, obesidad, desnutrición, corticoides, zonas débiles de la pared…
Los cuidadores del niño previamente instruidos, deben mantener el orificio limpio, seco y el catéter bien fijo.
Soluciones de diálisis peritoneal
Contienen agua, electrolitos, glucosa o icodextrina como agente osmótico y un tampón (lactato/bicarbonato).
|
Soluciones de diálisis peritoneal |
Soluciones DP Glucosa % Osmolaridad mosm/l Tampón mmol/l pH
Dianeal 1,36/2,27/3,86 344/395/483 Lactato: 35 5-6
Physioneal 1,36/2,27/3,86 344/395/483 Lactato: 25 Bicarbonato: 15 7,4
Extraneal Icodextrina 284 Lactato: 40 5-6
Nutrineal Aminoácidos 365 Lactato: 40 6,7
Gambrosol trio 1,5/2,5/3,9 357/409/483 Lactato : 40 5,5-6,5
Balance 1,5/2,3/4,24 358/401/511 Lactato: 25 Bicarbonato: 2 7
Bicavera 1,5/2,3/4,24 358/401/511 Bicarbonato: 4 7
Tampón bicarbonato:
El bicarbonato es el tampón ideal, alcanza un pH más fisiológico y persigue preservar la integridad celular peritoneal. La sustitución parcial o total del lactato por bicarbonato, mejora la biocompatibilidad, el dolor a la infusión y la acidosis, aunque su utilización en lactantes con peritoneo hiperpermeable puede producir alcalosis metabólica. Concentración de calcio. Se escogerá la solución de 1,75 mmol/l o de 1,25 mmol/l en función de la necesidad de balance neto positivo de calcio, niveles de fósforo y necesidad de quelantes del fósforo y vitamina D. Durante los dos primeros años de vida y durante la adolescencia la velocidad de crecimiento es muy elevada, por lo que con frecuencia es necesario utilizar soluciones con concentración de calcio de 1,75 mmol/l.
Aminoácidos
Aunque su efecto sobre el balance nitrogenado y la nutrición del enfermo no está totalmente demostrado, su utilización en niños en combinación con soluciones de bicarbonato es de valiosa ayuda en la protección de la membrana peritoneal y en la reducción de la exposición a la glucosa.
Icodextrina
Esta solución, capaz de mantener la ultrafiltración durante permanencias largas, sin duda ha contribuido al bienestar de pacientes con terapias continuas en DP, en especial en lactantes y niños anúricos con alto transporte de solutos y fallo relativo de ultrafiltración.
El uso diario de un intercambio con 12-14 horas de permanencia mejora la depuración semanal de urea y creatinina, así como, la extracción de sodio sin toxicidad de los metabolitos absorbidos (maltosa, maltotriosa y maltotetraosa). La combinación de soluciones con bicarbonato y aminoácidos durante la terapia nocturna y el mantenimiento de un prolongado intercambio diurno con icodextrina en diálisis automatizada son la base actual del tratamiento de niños con DP.
Determinación de presión hidrostática intraperitoneal (PHP):
Este sencillo e incruento test aporta valiosa información sobre el correcto volumen de infusión en cada paciente. La evaluación de la PHP consiste en la determinación de la presión que ejerce el fluido intraperitoneal sobre la pared abdominal y que es transmitida a la misma línea de drenaje del paciente. Para ello, determinamos los centímetros de fluido que se elevan sobre el punto medio abdominal localizado entre la intersección de la línea umbilical y la línea medio axilar.
Este procedimiento se realiza con diferentes volúmenes de infusión y en diferentes posturas para determinar el volumen adecuado en cada posición durante el tratamiento.
La PHP debe ser en cualquier caso inferior a 15 cmH2O. Un volumen óptimo de infusión suele acompañarse de presión hidrostática de 12 ±2 cmH2O. El volumen óptimo en sedestación y bipedestación es aproximadamente la mitad que en decúbito.
Test de equilibrio peritoneal (TEP)
Consiste en realizar una permanencia estandarizada de 4 horas y evaluar la relación entre la concentración de creatinina y de glucosa del líquido de diálisis (D) y del plasma (P). En la práctica, la realización del TEP nos informa de las características del transporte peritoneal y nos permite fijar el número de intercambios y el tiempo de permanencia de los mismos.
Facilita el conocimiento del tipo de membrana
Está indicada la realización de un TEP a partir del primer mes de tratamiento, una vez al año y siempre que existan cambios apreciables en el comportamiento del peritoneo.
Modalidades de diálisis peritoneal
Diálisis peritoneal continua ambulatoria (DPCA):
Consiste en cinco o seis intercambios diarios de líquido peritoneal introducido y drenado en la cavidad peritoneal por gravedad, de manera manual.
Diálisis peritoneal automática (DPA)
Se utilizan máquinas cicladoras para realizar intercambios rápidos nocturnos. Existen diferentes modalidades dependiendo del líquido que se infunda al terminar la sesión nocturna.
Al realizar la diálisis peritoneal, en cualquiera de sus dos modalidades, es importante hacer los intercambios en un área limpia y libre de corrientes de aire, ya que existe un riesgo de infección.
Hay que realizar una adecuada higiene de manos (jabón + antiséptico solución alcohólica) y en el momento de la conexión y desconexión del catéter peritoneal la colocación de mascarilla.
Prescripción y adecuación
En la prescripción inicial se comienza con volúmenes de infusión de 200 ml/m2/intercambio, aumentando lentamente cada 2-3 días hasta alcanzar 800-1200 ml/m2/intercambio a los 15-20 días del inicio, para ir acomodando al paciente a la distensión abdominal. Ajustar según la tolerabilidad clínica y la PHP.
La duración de cada intercambio, de 2-3 horas en niños grandes y entre 20 y 60 minutos en pequeños. En DPA, sesiones de 9 a 12 horas nocturnas. Ajuste según necesidades de UF y TEP. Usar soluciones de glucosa con la concentración más baja posible, tamponadas con bicarbonato, lactato o ambos, en doble cámara, con baja concentración de productos de degradación de la glucosa (PDG), pH más fisiológico y mayor biocompatibilidad. Utilizar la Icodextrina para permanencias largas. Considerar soluciones con aminoácidos para mejorar el estado nutricional en la proporción 3:1 (glucosa:aminoácidos).
Al mes del inicio de la diálisis, realizar test de equilibrio peritoneal, aclaramientos de urea (Kt/V) y creatinina y medida de la presión intraperitoneal. Ajustar prescripción personalizada y posteriormente de manera evolutiva valorando el estado clínico, nutricional y el crecimiento.
Adecuación: Mínimos Kt/V de 2,2 y aclaramiento de creatinina de 60 litros/semana/1,73m², ultrafiltración suficiente para evitar sobrecarga cardiocirculatoria, y adecuada nutrición, crecimiento e integración escolar, familiar y social.
Complicaciones no infecciosas
Afortunadamente la causa más frecuente de interrupción de un programa de DP en nuestro medio lo constituye el trasplante renal; sin embargo, el fracaso de la técnica, con necesidad de transferencia a HD, ocurre en un 15% de todos los pacientes que inician DP. La causa del fracaso es atribuida a:
Déficit de ultrafiltración por fallo de membrana
Debe descartarse previamente un mal drenaje del catéter, un incumplimiento de la prescripción (pauta de diálisis, dieta y restricción hidrosalina) o un descenso de la función renal residual. Ha de comprobarse con un intercambio hospitalario, una radiografía simple de abdomen y un estudio de permeabilidad peritoneal.
Hay tres tipos de fallo:
Tiene una incidencia de aproximadamente el 5% a los seis años de diálisis, se trata inicialmente con DPA con día seco (DPIN) y restricción hidrosalina, o con día húmedo (DPCC) utilizando polímeros de glucosa en los intercambios diurnos. En algunos casos será necesario un descanso peritoneal de entre 4-12 semanas, pasando transitoriamente el paciente a HD.
Es muy poco frecuente (<1%) y precisa de salida definitiva del programa de DP, con transferencia permanente a HD, además de un tratamiento específico.
Hipertensión arterial e hipervolemia
La causa más frecuente de hipertensión arterial en niños con DP, es la secundaria a un estado hipervolémico, asociado a un déficit de ultrafiltración por fallo de membrana, a una disminución o pérdida de la función renal residual (FRR), o a una prescripción inadecuada.
En todos los casos se complementará el tratamiento con una dieta de restricción hidrosalina y con el uso de diuréticos, si mantiene función renal residual, mejor que incrementar la concentración de glucosa.
Alteraciones electrolíticas. Acidosis metabólica
En recién nacidos y lactantes es frecuente la hiponatremia si no se administran aportes extras orales de sodio. Una hiponatremia leve puede observarse con el uso de polímeros de glucosa, aunque sin significación clínica.
La hipernatremia es excepcional a no ser que se utilicen soluciones hipertónicas con permanencias cortas. La hipopotasemia es relativamente frecuente debido a la ausencia de potasio en las soluciones. Se previene y trata aumentando la ingestión oral de alimentos ricos en potasio y excepcionalmente con suplementos. La hiperpotasemia es muy rara y se asocia a un incremento de ingesta, hipercatabolismo, acidosis y uso de fármacos antihipertensivos (beta bloqueantes, IECAs y ARA-II).
Las soluciones que contienen lactato como único buffera veces son insuficientes para controlar la acidosis, en especial si la ingesta proteica es excesiva. También es frecuente en niños con tubulopatías proximales o con tratamiento con soluciones de diálisis con aminoácidos. Se previene y corrige con una nutrición correcta, con aportes orales de bicarbonato, realizando como máximo un intercambio diario con solución de aminoácidos y con el uso de soluciones de diálisis con bicarbonato.
Anemia
El nivel diana de hemoglobina debe ser de 11-13 g/dl. Conseguir unos niveles adecuados de hemoglobina contribuye a un mayor bienestar del paciente desapareciendo los síntomas asociados a la uremia como son la anorexia o vómitos y en definitiva mejorando la situación nutricional. Se consigue mediante la utilización de Eritropoyetina beta subcutánea.
La mala respuesta suele deberse a unos depósitos inadecuados de hierro (ferritina y saturación de transferrina disminuidas y porcentaje de hematíes hipocromos aumentado), que se previene y corrige con aportes orales o intravenosos de hierro.
Enfermedad mineral ósea
La alteración mineral ósea va a ser muy importante por su asociación con el crecimiento y con la morbilidad cardiovascular. Se previene con restricción de fósforo en la dieta, uso de quelantes del fósforo, suplementos de calcio, análogos potentes de la vitamina D y una concentración adecuada de calcio en el dializado.
La alteración más frecuente en niños pequeños en diálisis peritoneal es la asociada a hiperparatiroidismo; sin embargo, la PTH parece tener también un efecto permisivo sobre el crecimiento óseo por lo que habrá que evitar su supresión excesiva. El rango óptimo de PTH entre 100 y 200 pg/ml, se asocia con un adecuado crecimiento y muy baja prevalencia de enfermedad ósea clínica/radiológica e hipercalcemia.
Malnutrición. Hipocrecimiento
En los niños existe una mayor pérdida proteica peritoneal que en el adulto, además de unas mayores necesidades para el crecimiento. Hay un efecto deletéreo de los altos trasportadores y una mejoría con las soluciones biocompatibles.
Se previene mediante el aporte calórico y proteico del 100% recomendado y hasta un 120% de las necesidades calóricas. El aporte extraordinario de calorías en forma de glucosa, por el líquido de diálisis, se estima en 7-12 kcal/kg/día. La anorexia y los vómitos, generalmente presentes en los lactantes con ERC, dificultan una óptima nutrición, pudiendo originar malnutrición. En esas situaciones, hay que recurrir a técnicas de alimentación enteral con sonda nasogástrica o de gastrostomía.
La siguiente tabla, muestra las determinaciones necesarias para estimar la situación nutritiva de niños en diálisis, así como, su periodicidad y el valor práctico de las mismas:
El retraso de crecimiento se previene con una correcta ingesta calórico-proteica, aportes extras de sodio, si se precisan, control de la acidosis y del hiperparatiroidismo y recibiendo una adecuada dosis de diálisis, existiendo una mejoría con soluciones biocompatibles, aunque van a ser muy importantes la función renal residual y una buena nutrición, más que la dosis de diálisis. Si a pesar de ello la velocidad de crecimiento esta disminuida y existe un retraso de talla, se puede realizar tratamiento con hormona de crecimiento recombinante (rGH).
Hernias inguinales. Fugas y escapes del líquido de diálisis
Muy frecuentes, especialmente en varones recién nacidos y lactantes. Es recomendable cerrar, si es posible, el conducto peritoneo-escrotal en el mismo acto quirúrgico de la implantación del catéter y adecuar el volumen de infusión evitando presiones hidrostáticas superiores a 14 cmH2O, utilizando técnicas de DPA intermitentes con día seco (DPIN), o DPCC con volúmenes diurnos del 50% respecto al nocturno.
Las fugas de líquido peritoneal incrementan el riesgo de peritonitis. Se previenen con una meticulosa implantación y acondicionamiento del catéter evitando su utilización precoz y con el uso de volúmenes adecuados. El tratamiento se basa, si es posible, en el descanso peritoneal transitorio, disminución del volumen de infusión, técnicas de DPA intermitentes con día seco (DPIN) y si es necesario con la revisión quirúrgica. El hidrotórax es una complicación excepcional y potencialmente grave que puede cursar de forma silente o producir fracaso respiratorio. Es más frecuente en el lado derecho coincidiendo con defecto diafragmático no detectado y requiere cirugía o pleurodesis.
Dolor
Se puede prevenir con un catéter adecuado con punta en espiral y correcta posición intraperitoneal, prescripción de volúmenes adecuados de infusión y soluciones con bicarbonato. Habrá que descartar siempre una posible peritonitis.
Hemoperitoneo
Puede surgir tras la implantación del catéter y habitualmente es asintomático y de escasa cuantía. Se describe también en mujeres durante la ovulación y la menstruación. Mejora con el reposo del paciente, lavados frecuentes con líquido fresco y heparina intraperitoneal (no se absorbe) para evitar obstrucción del catéter por coágulos.
Complicaciones infecciosas
Es la complicación más frecuente en DP y la comorbilidad más importante de hospitalización y fracaso de la técnica con trasferencia a HD. Preventivamente la utilización de soluciones biocompatibles (menor inflamación peritoneal e interferencia con los mecanismos de defensa peritoneales) y las técnicas intermitentes discontinuas (DPIN), en pacientes susceptibles de su utilización, mejoran la capacidad defensiva peritoneal.
El diagnóstico se hace con un líquido turbio y más de 100 cl/mm3 de leucocitos y al menos 50% de polimorfonucleares, asociado generalmente a dolor abdominal, vómitos y dificultad o disminución del drenaje peritoneal. En lactantes no es infrecuente la bacteriemia con clínica de sepsis.
Los microorganismos más frecuentes son los grampositivos aunque los lactantes con pañales son más vulnerables a infecciones por gramnegativos y fundamentalmente Pseudomonas. Actualmente habrá que tener en cuenta, también, a las micobacterias, en aquellas peritonitis sin crecimiento bacteriano, ya que precisan métodos específicos de cultivo.
El tratamiento inicial debe ser empírico e intraperitoneal, cubriendo gérmenes grampositivos y gramnegativos.
Se añade heparina (1000 U/l) hasta que el líquido aclare, para evitar la obstrucción del catéter.
La administración intermitente, en un solo intercambio de al menos 4-6 horas de permanencia, ha mostrado ser igual de efectiva que el tratamiento continuado excepto cuando existe función renal residual.
Se debe de valorar la retirada del catéter en peritonitis resistentes a partir del tercer o cuarto día, en especial si se trata de una peritonitis por hongos o por micobacterias.
Puede causar, secundariamente, una infección del túnel subcutáneo y peritonitis. Debe prevenirse con su cuidado diario meticuloso debiendo estar muy seco y muy limpio, además de mantener una buena fijación del catéter para evitar estiramientos.
Se acompaña de síntomas evidentes de infección como enrojecimiento, dolor, tumefacción y/o exudado purulento. Son factores de riesgo la edad inferior a dos años y el ser portador de una ostomía (gastrostomía, ureterostomía o colostomía). El cambio frecuente de pañales o la utilización de doble pañal en pacientes con urostomías ayuda a mantener el orificio seco.
Los microorganismos más frecuentes son Pseudomonas aeruginosa y Staphylococcus aureus. El tratamiento debe incluir aplicaciones tópicas de suero salino hipertónico y antibioterapia sistémica, preferentemente por vía oral, dependiendo de la sensibilidad del patógeno.
Existen distintas alternativas terapéuticas para el niño con ERT, cuando ya no es posible el tratamiento conservador de dicha situación: hemodiálisis, diálisis peritoneal y trasplante, siendo el trasplante renal (TR) el tratamiento sustitutivo de elección en el niño con ERT, el que proporciona mejor calidad y expectativa de vida. El número de niños que recibe un trasplante renal en nuestro país permanece constante en 60-70 niños/año y la mayoría (>80%) cuando se trasladan a las unidades de adultos, lo hacen con un injerto renal funcionante.
El objetivo del tratamiento en el trasplante es conseguir la modificación de la respuesta inmune del receptor para que acepte como propio un órgano extraño. A pesar de los avances en la inmunosupresión y el mejor conocimiento de la respuesta inmune, hoy en día todavía esto no es posible sin someter al sujeto a los riesgos de una inmunosupresión potente.
La mayoría de genes implicados en la respuesta inmune se ubican en el cromosoma 6, en el llamado complejo mayor de histocompatibilidad (CMH) que incluye los genes de los antígenos humanos de los leucocitos (sistema HLA).
Estudios Inmunológicos del donante (D) y el receptor (R)
Grupo sanguíneo ABO:
En todos los casos debe existir compatibilidad de grupo ABO entre donante y receptor. Por un criterio de justicia distributiva, los órganos de Donantes Cadavéricos (DC) se adjudicarán por isogrupo (identidad ABO entre D y R), mientras que en el trasplante con Donante Vivo (DV) solo se buscará la compatibilidad de grupo.
Si existe incompatibilidad ABO se podrán realizar, previamente al trasplante, tratamientos desensibilizadores dirigidos a eliminar las isoaglutininas presentes en el receptor y con ello permitir el éxito del mismo.
Tipaje HLA
Previamente a su entrada en lista de espera de TR se procederá a identificar los antígenos HLA del receptor, con el fin de, ante un potencial donante, poder cuantificar el número de antígenos HLA compartidos entre D y R. Los antígenos HLA más importantes en el proceso de trasplante son, por orden, HLA DR, B y A. Los antígenos C, DP y DQ cada vez tienen más peso en este proceso debido a posibles sensibilizaciones específicas frente a ellos en caso de pacientes retrasplantados.La frecuencia de determinados antígenos varía en función de la raza.
Además del Sistema Mayor de Histocompatibilidad existen otros sistemas menores lo que significa que, aun teniendo una identidad HLA completa (6/6) entre D y R, solo los trasplantes entre gemelos idénticos pueden llevarse a cabo sin inmunosupresión.
Anticuerpos (Ac) anti-HLA
La sensibilización es el proceso por el cual se desarrollan Ac. frente a antígenos HLA, y puede deberse a trasplantes previos, transfusiones de hematíes o plaquetas, gestaciones previas o al desarrollo de Ac. frente a un órgano trasplantado en el contexto de un rechazo agudo (RA) o crónico.
Prueba cruzada (cross-match) por CDC o linfocitotoxicidad
Esta prueba se realiza antes de la aceptación de un órgano para trasplantarlo a un determinado receptor y consiste en incubar suero del receptor con Linfocitos T y B del donante en presencia de complemento. Detecta la presencia en el suero del receptor de anticuerpos específicos contra antígenos del donante. En caso de ser (+) traduce un riesgo de pérdida del injerto en las 48 horas postrasplante del 80% y por tanto se considera éste contraindicado.
Estudio del receptor
El estudio del receptor va encaminado a conocer y minimizar en lo posible los riesgos del niño que va a trasplantarse y debe de iniciarse con la antelación suficiente para evitar, si es posible, su paso por diálisis.
|
Estudio del receptor previo al trasplante |
|
|
Es importante valorar:
a) La enfermedad renal primaria:
Enfermedades con posibilidad de recurrencia en el injerto: la recurrencia de la enfermedad renal primaria causa el 7% de las pérdidas de injertos y es más frecuente en los retrasplantes. Suelen ser enfermedades glomerulares.
Enfermedades estructurales: las uropatías obstructivas (la más frecuente las VUP) y la displasia renal son la primera causa de ERT en el niño y este tipo de patología debe ser evaluada previamente al trasplante por el urólogo pediátrico.
Se precisa una CUMS y una evaluación urodinámica para valorar la necesidad de cirugía previa con el objetivo de conseguir una vejiga continente, con capacidad adecuada y de baja presión. La nefrectomía de riñones propios previa al TR, o en el acto del mismo, no suele ser necesaria y sus indicaciones más frecuentes son: la proteinuria masiva, las pielonefritis recurrentes y la hipertensión arterial (HTA) refractaria; ocasionalmente la falta de espacio para ubicar el trasplante y la poliuria masiva puede ser otras razones.
Enfermedades metabólicas y/o sistémicas: hiperoxaluria, cistinosis, enfermedad de Fabry, etc. Requieren tratamiento individualizado y mantener el tratamiento de la enfermedad primaria tras el TR para evitar, en lo posible, la progresión de la enfermedad a nivel sistémico y/o sus consecuencias sobre el injerto.
Enfermedades asociadas a otras patologías: las enfermedades genéticas (poliquistosis, nefronoptisis, etc.) y las estructurales pueden coexistir con alteración de otros órganos (alteraciones hepáticas, neurológicas, esqueléticas, oculares, etc.) planteando a veces el TR hepatorenal simultáneo y/o consecutivo. No son contraindicación para el TR pero requieren evaluación individualizada.
Enfermedad renal tras el TR de otros órganos: la exposición a inmunosupresores anticalcineurínicos (ciclosporina y tacrolimus) a largo plazo y otros factores puede conducir a la ERT e implicar la necesidad de TR.
b) El riesgo inmunológico
Nos permite identificar a los pacientes con mayor riesgo de desarrollar rechazo agudo y/o crónico e individualizar, en lo posible, el tratamiento inmunosupresor. La inmunología en los últimos años ha experimentado enormes avances y se han traspasado las barreras del grupo ABO y de la histocompatibilidad siendo posible el trasplante ABO-incompatible (ABOi) y el trasplante en pacientes hiperinmunizados con protocolos inmunosupresores específicos para este tipo de TR.
Los pacientes sometidos a un retrasplante se consideran de mayor riesgo inmunológico.
c) El riesgo infeccioso
Realizamos Mantoux previo al TR y hay que confirmar que el niño haya recibido todas las vacunas apropiadas para su edad (además de gripe anual, hepatitis A y antineumocócica), así como, que haya alcanzado inmunidad frente a las mismas. Asimismo debemos conocer su situación serológica frente a CMV, virus de EB, hepatitis A, B, C, HIV, herpes simple y herpes 6, toxoplasma, parvovirus, varicela, sarampión, parotiditis y rubeola. Es necesaria la exploración minuciosa de posibles focos de infección, incluyendo la inspección dental.
d) La edad
Se han realizado TR renales en lactantes, pero en general el TR se indica en niños a partir de los 18 meses y con un peso superior a los 8 kg, dada la dificultad en la técnica quirúrgica y el mayor riesgo de trombosis en los más pequeños. Los adolescentes se consideran un grupo de riesgo por la alta frecuencia de incumplimiento terapéutico en esta población.
e) Los grandes vasos abdominales
Mediante una ecografía-Doppler se confirmará la permeabilidad de los grandes vasos abdominales. Solo en algún caso complejo se necesitan otras técnicas diagnósticas (angio-TAC, angio-RNM, etc.).
f) Otros riesgos
El riesgo psicosocial (sobre todo la no-adherencia al tratamiento), la posibilidad de mayor riesgo de trombosis, el riesgo cardiovascular, etc., requieren en muchos casos una valoración multidisciplinar para garantizar al máximo la supervivencia del paciente y del injerto. No olvidar la encuesta previa de posibles alergias.
Estudio del donante renal
Según datos de la ONT, en el año 2012 en España se realizaron un total de 2551 TR renales (adultos + infantiles), de los cuales 86% procedían de DC y solo un 14% fueron de DV. Entre los donantes cadáver, el 90,8% fueron donantes en muerte encefálica (también llamado donante a corazón latiente) y una minoría (9,2%) fueron donantes en asistolia o a corazón parado.
En TR renal infantil, la mayor parte de órganos proceden de DC en muerte encefálica, pero la actividad trasplantadora con DV, aun siendo pequeña, es proporcionalmente superior a los centros de adultos y está en constante aumento: 17,7% en el año 2009, frente a 30,5% en 2012 (aunque con una distribución muy variable entre los distintos centros).
Donante cadáver
En la mayor parte de las comunidades autónomas se considera al receptor pediátrico como prioritario frente al adulto y por ello los tiempos en lista de espera son mucho más cortos, pudiéndose realizar en algunos casos el trasplante en situación de prediálisis (22% en el año 2012).
La expectativa de vida del receptor infantil es superior a la del adulto por lo que la calidad del órgano a trasplantar debe ser extraordinaria. Por ello no se aceptan los llamados órganos de donantes marginales o de criterios expandidos (edad <3 años o >55 años, donante en asistolia, donante con patología cardiovascular o nefropatía).
Criterios de exclusión de un potencial donante:
|
Criterios absolutos de exclusión |
|
•HIV+ •Infección por el virus HTLV I y II •Infección aguda por Trypanosoma cruzi(enfermedad de Chagas) •Enfermedad por priones (Creutzfeldt-Jakob, Kuru) •Sepsis o infección diseminada no controlada •Coagulación Intravascular Diseminada •Enfermedad tumoral maligna con capacidad metastatizante (excepto tumores del SNC, cáncer cutáneo no-melanoma de bajo grado y carcinoma in situ de cérvix) •Enfermedad renal crónica o nefropatía establecida con daño estructural
|
|
Criterios relativos de exclusión |
|
•Donantes con infección por HBV y/o HCV (solo aceptado para receptores con PCR+) •Edad del donante <3 años por los peores resultados demostrados y mayor riesgo de trombosis del injerto •Donante en asistolia o con isquemia caliente prolongada •Daño renal agudo grave preextracción •Hipertensión arterial y/o diabetes mellitus establecidas
|
Donante vivo
La utilización de riñones de DV va en aumento en España. En la mayoría de los TR infantiles proceden de uno de los progenitores. El TR de DV no siempre es posible; existen series descritas en las que hasta en 75% de los casos estudiados, existe alguna contraindicación a la donación. Las más frecuentes: incompatibilidad ABO, sensibilización del receptor frente al potencial donante, detección de alguna enfermedad que limita la donación, o incluso motivos sociales.
El procedimiento de estudio y aceptación de un potencial donante vivo se inicia con la anamnesis y exploración física y se acompaña de una serie de exploraciones complementarias obligatorias, a las que se suman una serie de exploraciones especiales dirigidas al estudio de riesgos específicos de cada individuo (por ejemplo, espirometría en pacientes fumadores).
Este protocolo de estudio tiene como objetivos principales:
Una vez concluido el estudio y con las valoraciones favorables de nefrología, urología, anestesia, psicología y coordinación de trasplantes, el trasplante de vivo se somete a valoración conjunta por todos los especialistas y el inmunólogo (Comité de Donante Vivo), procediéndose a su aceptación o rechazo.
En caso de aceptación, una semana antes de la cirugía del TR se realiza la prueba cruzada definitiva por CDC y por citometría de flujo que deberá ser negativa, y como mínimo 24 horas antes de la cirugía se realizará el registro legal de la donación ante el juez, en presencia del donante, el nefrólogo, el urólogo y el coordinador. Cumplidos todos estos requisitos de forma adecuada se puede proceder a la cirugía del trasplante.
Etapas de estudio de un potencial donante vivo
|
Pruebas obligatorias |
||||
|
•Anamnesis. Antecedentes personales y familiares •Exploración física completa •Determinación múltiple de PA •Bioquímica general de sangre con estudio completo de coagulación •Bioquímica de orina con aclaramiento de creatinina y valoración de proteinuria en 24 horas •Sedimento de orina y urinocultivo •Serologías HBV, HCV, HIV, CMV, EBV, toxoplasma y sífilis •Mantoux •Test de tolerancia a glucosa oral y HbA1c •Marcadores tumorales: PSA en varones •Grupo ABO y Tipaje HLA •Prueba cruzada donante/receptor •Radiografía de tórax y abdomen •Ecografía abdominal •ECG, ecocardiograma •Angio-TAC abdominal •Citología vaginal y mamografía en mujeres
•Ecocardiograma de estrés •Monitorización ambulatoria de presión arterial (MAPA) •Espirometría si tabaquismo •Colonoscopia
•Psicólogo: riesgo psicológico y afectivo •Coordinador de trasplantes: riesgo social y aspectos legales •Nefrólogo: verificación de idoneidad médica •Urólogo: verificación de idoneidad quirúrgica •Anestesista: valoración de riesgo y estrategia anestésica
|
Contraindicaciones para el trasplante renal con donante vivo
•Edad <18 años o >55 años •Hipertensión arterial mantenida •Obesidad con IMC >30 kg/m2 •Diabetes •Síndrome metabólico •Enfermedad cardiovascular: coronariopatía, vasculopatía periférica, AVC •FG <80 ml/min/1,73 m2 •Albuminuria >30 mg/24 horas •Neoplasias no curadas •Serología positiva para HBV, HCV (salvo si receptor con PCR viral positiva) •Serología positiva HIV •Alteraciones estructurales renales o vasculares que imposibiliten la cirugía •Enfermedad renal crónica •Enfermedades sistémicas con riesgo de afectación renal: LES •Enfermedades crónicas graves: EPOC, Crohn, CU, etc. •Infecciones activas: TBC, Chagas, Paludismo, etc
•Mal cumplimiento terapéutico •Nefropatía primaria con muy alto riesgo de recidiva post-trasplante: –SHU atípico –HFS recidivada en un trasplante previo –Enfermedad de Alport con desarrollo de anticuerpos anti MBG –Hiperoxaluria primaria |
Inmunosupresión
Los avances en el tratamiento inmunosupresor han disminuido la frecuencia del rechazo agudo (RA) y ha contribuido a una mejor supervivencia a corto y largo plazo del injerto renal en niños. El objetivo de la inmunosupresión (IS) es evitar el rechazo del injerto. El protocolo inmunosupresor varía en función del riesgo inmunológico, características específicas de D y R y de la enfermedad renal primaria, entre otros.
La estrategia de IS más común se compone de la combinación de: tratamiento de inducción, esteroides, un fármaco antiproliferativo y un fármaco inhibidor de la calcineurina.
La intensidad del tratamiento IS es mayor en los primeros días (fase de inducción), disminuyéndose en los meses posteriores (fase de mantenimiento).
La inmunosupresión conlleva riesgo de infecciones, tumores, nefrotoxicidad, retraso del crecimiento y otros efectos secundarios, por lo que se tiende a estrategias inmunosupresoras de minimización de los fármacos potencialmente más deletéreos para el niño.
Nuevos protocolos inmunosupresores:
Cirugía del trasplante
La ubicación habitual del injerto renal es heterotópica en la cavidad abdominal, en fosa ilíaca (preferentemente derecha) y localización mayoritariamente extraperitoneal.
Los vasos del injerto se anastomosan a los vasos abdominales del receptor: en niños mayores a los vasos ilíacos externos, en pequeños a vasos ilíacos comunes y en muy pequeños al segmento terminal de aorta y cava (entonces con posible ubicación intraperitoneal del injerto).El uréter se anastomosa a la vejiga, ya sea con un mecanismo antireflujo o sin él, pero en este último caso deberá dejarse un tutor ureteral temporal. Se dejará siempre una sonda vesical durante un mínimo de siete días postrasplante y habitualmente también un drenaje en lecho quirúrgico.
Postrasplante inmediato
El manejo postoperatorio inmediato del niño trasplantado renal consiste en:
Postoperatorio con diuresis inicial
Es habitual que el niño inicie diuresis inmediata en quirófano, la cual suele ser eficaz (descenso de creatinina), y ello facilita mucho su manejo. El tratamiento en estos casos va dirigido a reponer de forma horaria y completa (volumen por volumen) la diuresis total (riñón trasplantado y riñones nativos) junto con las pérdidas insensibles y pérdidas de drenajes si son significativas.
Se realizará eco-Doppler en las primeras 24 horas, o antes si el paciente lo requiere, con el fin de descartar posibles complicaciones.
A partir de las 24 horas, el niño suele iniciar tolerancia oral. Cuando la ingesta hídrica es adecuada, se reduce progresivamente la reposición de la diuresis y se ajusta la fluidoterapia a cada 12-24 horas en goteo fijo, con habitual retirada del aporte IV durante la primera semana. El manejo adecuado de sondas, vías venosas y drenajes, la fisioterapia respiratoria y unas adecuadas medidas de higiene son fundamentales en el cuidado del niño trasplantado.
Postoperatorio sin diuresis inicial (retraso de la función del injerto)
La oliguria o anuria inicial requieren un diagnóstico y tratamiento inmediato:
Postoperatorio con diuresis inicial y oligoanuria posterior
En caso de oligoanuria tardía tras el inicio de diuresis, las causas a excluir son las mismas que en el retraso de la función del injerto, a las que añadiremos:
Complicaciones inmunológicas
Denominamos rechazo del injerto al proceso biológico por el cual el sistema inmunológico del receptor reconoce como ajenas a las células del órgano injertado y en consecuencia, inicia una serie de procesos que tienen como fin la destrucción del mismo.
La incidencia de rechazo agudo del injerto durante el primer año del trasplante era del 40-50% en la era de la inmunosupresión basada en ciclosporina + azatioprina + esteroides, mientras que ha descendido a un 10-20% con la actual inmunosupresión más potente constituida por tacrolimus + micofenolato + esteroides.
Clásicamente se distinguen tres tipos de rechazo: hiperagudo, agudo y crónico.
Sucede habitualmente en las primeras horas, o incluso minutos, tras la reperfusión del órgano e implica la trombosis masiva del injerto y su pérdida inmediata. La realización de la prueba cruzada pretrasplante (ver Inmunología del TR) ha eliminado prácticamente su presentación post-TR.
Se traduce clínicamente con un deterioro de la función del injerto, que puede acontecer en cualquier momento de la sobrevida de un órgano trasplantado. Hablamos de RA precoz cuando ocurre en los tres primeros meses del TR, o RA tardío si tiene lugar más allá del primer trimestre. La presencia de RA tiene impacto negativo en la supervivencia del injerto a largo plazo, y como factores de mal pronóstico asociados al RA tenemos: el número total de episodios, su no reversibilidad tras el tratamiento, la severidad histológica y la aparición tardía.
Puede ser celular (RCC) o humoral (RCH). Su diagnóstico es anatomopatológico y el tratamiento es controvertido, siendo el RCH una causa importante de pérdida del injerto.
La Nefropatía crónica del injerto es responsable del 33% de las pérdidas funcionales de injertos renales a largo plazo. A nivel clínico se manifiesta con un progresivo deterioro funcional del injerto que se acompaña de proteinuria en rango variable y que no puede ser atribuido a otras causas. A nivel histológico se hallan diferentes grados de fibrosis intersticial y atrofia tubular (IFTA).
Diagnóstico del rechazo agudo (RA) del injerto
La sospecha clínica se basa en la disfunción del órgano (elevación de las cifras de creatinina +/- descenso de la diuresis +/- injerto turgente y doloroso a la palpación). Ante estos datos clínicos, (a los que pueden añadirse HTA, anemización, eosinofilia periférica, febrícula, etc.) se deberá realizar una eco-Doppler del injerto que puede identificar signos ecográficos sugestivos de RA (injerto globuloso, hiperecogeneicidad del parénquima renal, pérdida de la diferenciación córtico-medular y elevación de los Índices de Resistencia vascular) y también permitirá descartar otras causas de disfunción aguda renal.
El diagnóstico es anatomopatológico por biopsia renal.
Simultáneamente, se obtendrá una muestra de suero del receptor para proceder al estudio en fase sólida de la posible presencia de anticuerpos anti-HLA donante específicos (ADE). Todo ello permite conocer la etiología del daño y su severidad y así establecer una estrategia terapéutica adecuada al problema de origen.
Tratamiento del RA del injerto
Si no se puede realizar la biopsia renal de forma inmediata, tras la sospecha clínica podemos iniciar tratamiento empírico con3-5 pulsos de metilprednisolona a días consecutivos o alternos y a dosis de 300 mg/m2/dosis (máx. 500 mg/día) IV.
Con este tratamiento revierten el 80-90% de los episodios de RA precoces, consiguiéndose la normalización funcional del injerto en pocos días.
Si la respuesta al tratamiento empírico del RA es parcial o inexistente, es obligada la Biopsia Renal y proceder a iniciar tratamiento específico según los hallazgos anatomopatológicos.
Complicaciones no inmunológicas
Quirúrgicas:
Precoces:
Tardías:
Infecciosas
La infección es la primera causa de mortalidad en niños trasplantados (28,5%), la causa más frecuente de ingreso tras el trasplante y contribuye a la pérdida del injerto.
El riesgo de infección oportunista disminuye con el transcurso del tiempo y con la disminución progresiva de la inmunosupresión. La identificación serológica de virus (CMV, EBV) en D y R permite estratificar el riesgo de transmisión y aplicar las medidas preventivas adecuadas a cada caso. El uso de profilaxis ha contribuido a la práctica desaparición de enfermedades oportunistas como el Pneumocystis jiroveci(trimetropim-sulfametoxazol durante los primeros seis meses) y ha mejorado el curso de otras como el CMV (ganciclovir y/o valganciclovir en terapia anticipada o profilaxis universal), pero la infección sigue siendo un reto en el manejo de estos pacientes. Tras el trasplante hay que seguir cumpliendo el calendario vacunal que corresponda a la edad del R pero evitando las vacunas de virus vivos y añadiendo otras como la vacuna antigripal anual.
Infecciones frecuentes:
-Citomegalovirus: Su incidencia es alta y suele ser de aparición precoz. Los síntomas varían desde enfermedad invasiva grave a cuadros leves y/o alteraciones analíticas (neutropenia, aumento enzimas hepáticas, etc.).
-Varicela-zóster: Conocer el estado serológico del R frente al virus y la posible vacunación previa al trasplante son imprescindibles para evitar los casos graves. El tratamiento es aciclovir IV y la disminución o retirada del micofenolato.
-Virus de Epstein Barr: Su importancia va asociada a su poder oncogénico (síndrome linfoproliferativo postrasplante). Podemos detectar su presencia mediante PCR o carga viral en sangre pero no está bien establecido su tratamiento.
En la práctica clínica, la infección crónica asintomática a EB obliga a vigilancia estrecha y con frecuencia a disminuir la inmunosupresión.
-Parvovirus: Puede asociarse a pancitopenia o anemia aplásica en inmunodeprimidos. Para su confirmación se realizará una biopsia renal. Su tratamiento inicial consiste en disminuir IS.
Cardiovasculares
La HTA es frecuente y es un factor de riesgo evolutivo y modificable para el paciente y el injerto. La etiología suele ser multifactorial y el tratamiento puede ser ocasionalmente quirúrgico (angioplastia en estenosis de arteria renal y nefrectomía de riñones nativos si estos son la causa) pero en general se maneja con tratamiento farmacológico y con cambio del estilo de vida. Es recomendable la monitorización periódica de la presión arterial ambulatoria (MAPA).
Cáncer
Es una complicación derivada de la inmunosupresión y causa de muerte en 11,3% de los pacientes de la serie americana (NAPRTCS). El síndrome linfoproliferativo postrasplante (PTLD) es el cáncer más frecuente en el niño trasplantado.
Resultados
En las últimas décadas los resultados del trasplante renal infantil han presentado una progresiva y continua mejoría, tanto en la supervivencia del injerto renal como en la del receptor, en su calidad de vida y en otros aspectos psicosociales. Todo ello gracias a la mejora en el manejo global de estos pacientes en la etapa de ERT (aspectos nutricionales, rGH, eritropoyetina, trasplante en pre-diálisis, etc.) y a las mejoras incorporadas en la etapa de trasplante (nuevos fármacos inmunosupresores, trasplante con donante vivo, nuevos fármacos antivirales como el valganciclovir, etc.).
Supervivencia del receptor
El 93% de los receptores de un trasplante renal en edad pediátrica alcanzan los 20 años de edad, y esta cifra va en progresivo aumento. Dado que los resultados del TR renal son globalmente mejores en el trasplante con DV que con el DC, las supervivencias tanto de receptor como de injerto se suelen reportar por separado y son discretamente diferentes en función de las series analizadas.
Supervivencia del injerto
La supervivencia del injerto es, de forma universal, sensiblemente mejor en el trasplante con DV emparentado que con el DC, presentando una expectativa de vida media de 19,6 ±1,3 años según datos de la NAPRTCS.
En lo que respecta a la supervivencia del injerto de DC ha mejorado en los últimos años y de forma mucho más evidente que la del DV:
La ERC en el paciente pediátrico tiene repercusiones psicológicas y sociales tanto en el paciente como en su familia. El tratamiento de un niño con ERC está no solo encaminado a prolongar su vida en las mejores condiciones físicas, sino a lograr una completa adaptación social incluyendo la asistencia normal al colegio, participación en deportes...
Es aconsejable la valoración y el seguimiento por parte de Psicología de los pacientes con ERC y sus familias, especialmente aquellos en preparación para el trasplante renal o que inician terapia con diálisis, y en todos aquellos que presenten problemas de adhesión al tratamiento u otros signos de mala adaptación a su enfermedad. La adolescencia y el momento de la transferencia a una unidad de adultos son etapas de especial riesgo.
Tanto la información acerca de las distintas opciones de tratamiento sustitutivo, como el estudio de preparación para el trasplante, deben realizarse en etapas no muy avanzadas de la enfermedad renal crónica, aconsejable una vez que el FG descienda por debajo de 30 ml/min/1,73 m2
La mayoría de los pacientes con enfermedades crónicas precisan una adaptación específica de las inmunizaciones existentes. Algunos de ellos pueden encontrarse inmunodeprimidos, tanto por la propia enfermedad como por inmunosupresores.
El padecimiento de cualquier enfermedad inmunoprevenible puede desestabilizar al paciente con una enfermedad crónica, incluso de forma grave y letal, con mayor frecuencia que a individuos sanos. Por ejemplo, el riesgo de padecer una enfermedad neumocócica invasora es 2 veces superior en niños con enfermedades crónicas que en niños sanos. Y en otros estudios se observa un riesgo de padecer una infección grave por el virus de la gripe de 2 a 4 veces superior en niños pertenecientes a los clásicos grupos de riesgo.
De ahí la importancia especial de asegurar de la forma más completa posible las inmunizaciones previstas para ellos. Esto es complicado en numerosas ocasiones, ya que las reagudizaciones y los episodios intercurrentes pueden retrasar la pauta indicada, siendo más evidente para las vacunas no incluidas en los calendarios oficiales, a pesar de que todos los pacientes crónicos las tienen habitualmente aseguradas de forma gratuita.
La mayoría de estos pacientes, si no están inmunodeprimidos, pueden recibir todas las vacunas oficiales del calendario. Asimismo, de forma general, se recomienda que estén adecuadamente inmunizados frente a las siguientes infecciones:
Por otro lado, aquellos que sí tengan inmnunosupresión, si deberán recibir una única dosis de refuerzo a los 5 años de la anterior; es decir, el máximo de dosis de vacuna VNP23 actualmente son 2 dosis.
Finalmente, debe considerarse siempre la optimización de la vacunación en todos los convivientes de enfermos crónicos, tanto de las vacunas incluidas en el calendario oficial como de otras no sistemáticas como la de la gripe y la de la varicela. Esta es una forma muy eficaz de protección indirecta de los niños inmunodeprimidos y de los que padecen enfermedades crónicas.
En niños con ERC, se debe optimizar al máximo el calendario oficial, aunque esto es complicado debido a los habituales procesos intercurrentes.
En pacientes con nefropatía sometidos a hemodiálisis, es fundamental asegurar la protección frente a la hepatitis B, por lo que deben hacerse controles serológicos y revacunación, si es necesario.
En las personas candidatas a un trasplante, no es infrecuente que la respuesta a las vacunas esté disminuida, dependiendo del tipo y grado de enfermedad, pero en cualquier caso es superior que la que se obtendrá después del trasplante, cuando ya existe una situación de inmunodepresión producida por los fármacos destinados a evitar el rechazo del injerto.
Por tanto, es de importancia primordial vacunar al niño antes de realizar el trasplante y lo más pronto posible antes de que la enfermedad de base progrese.
Una vez que el trasplante se ha efectuado, las respuestas a las vacunas van a ser subóptimas (particularmente en los niños que reciben micofenolato e inhibidores de la rapamicina como el sirolimus o el everolimus), aunque una proporción variable de niños alcanza títulos protectores. Además, en el período postrasplante, muchos sujetos previamente inmunes pierden los anticuerpos y se vuelven susceptibles.
Las vacunas inactivadas son seguras en las personas trasplantadas. Sin embargo, las vacunas con microorganismos vivos están contraindicadas en el periodo postrasplante y deberían evitarse en el mes previo al trasplante.
En cualquier caso, dada la seguridad de estas vacunas en los pacientes trasplantados y su beneficio potencial, la vacunación anual frente a la gripe está indicada tanto en los candidatos a un trasplante como en las personas que ya han recibido el injerto. En este último caso suele administrarse a partir de 3-6 meses después del trasplante. Sin embargo, en caso de riesgo de adquirir la enfermedad, puede vacunarse antes de este plazo, ya que se obtienen respuestas protectoras en un porcentaje no despreciable de las personas sin un incremento significativo de efectos secundarios.
Esto, remarca la importancia de completar las vacunaciones antes del trasplante, utilizando, si es necesario, esquemas acelerados. En general, se recomienda la pauta habitual de 0, 1 y 6 meses, pero si hay dudas de que esta pauta pueda llevarse a cabo por la inminencia del trasplante, pueden utilizarse diferentes pautas aceleradas: 0, 7 y 21 días; 0, 10 y 21 días; y 0, 1, 2 y 12 meses, aunque otras diferentes son también posibles. Estos esquemas son menos inmunógenos que la pauta de 0, 1 y 6 meses, pero en un porcentaje significativo de sujetos se alcanzan títulos seroprotectores.
Entre 1 y 3 meses después de completar la vacunación, se recomienda determinar el título de anticuerpos (anti-HBs) para determinar la respuesta inmune del sujeto y valorar la necesidad de dosis adicionales de vacuna.
La vacunación se lleva a cabo con 2 dosis de la vacuna separadas por un intervalo de, al menos, 6 meses.
No hay experiencia de vacunación frente a la hepatitis A con esquemas acelerados, pero en cualquier caso es aconsejable que el paciente que espera un trasplante reciba las 2 dosis de la vacuna con un intervalo menor de 6 meses si se prevé que el trasplante tenga lugar en un periodo de tiempo menor.
La respuesta a la vacuna una vez realizado el trasplante es menor que en el periodo pretrasplante. Además, también en este caso se produce una disminución muy rápida de los títulos de anticuerpos en los dos años siguientes al trasplante.
Entre 1 y 3 meses después de la vacunación, se recomienda verificar el estado de seroprotección para administrar dosis de recuerdo si fuera necesario.
Como sucede con otras vacunas, los títulos de anticuerpos frente al neumococo disminuyen de forma marcada en los 3 años siguientes al trasplante.
Por todo lo anterior, se recomienda la vacunación frente al neumococo utilizando la VNC13 y la VNP23.
Dentro de la bibliografía consultada hay artículos muy interesantes de los cuales he seleccionado los siguientes:
Título: Fracaso renal agudo en niños críticos: epidemiología y factores pronósticos
Fecha de publicación: 5-jul-2012
Este artículo tiene como objetivo el describir las características epidemiológicas del FRA en las Unidades de Cuidados Intensivos Pediátricos (UCIPs) españolas, así como identificar factores de riesgo de mortalidad y de necesidad de depuración extrarrenal al alta, mediante un estudio prospectivo observacional multicéntrico entre el 15 de octubre de 2002 y el 15 de octubre de 2003 en 19 UCIPs españolas que incluyó los niños ingresados en UCIP entre 7 días y 16 años de edad con una alteración aguda de la función renal.
Título: Enfermedad renal crónica no terminal en los pacientes en edad pediátrica ingresados y seguidos en consulta de Nefrología
Fecha de publicación: Matanzas ene.-feb. 2013
Este artículo pretende determinar la incidencia de la enfermedad renal crónica infantil en la provincia de Matanzas (Cuba), describir la historia natural de la enfermedad, estudiar aquellos factores que puedan influir en el curso de la misma y crear las bases para elaborar un protocolo estándar para la vigilancia y el tratamiento de estos pacientes, mediante una investigación descriptiva, transversal, en el Hospital Provincial Pediátrico Docente de Matanzas, en el período comprendido entre el 1 de enero de 2000 y el 31 de diciembre de 2011.
Título: Enfermedad renal crónica en pediatría y nuevos marcadores moleculares
Fecha de publicación: Santiago abr. 2012
En este artículo se discute la aparición de nuevos marcadores moleculares del metabolismo mineral que junto a la biología molecular han contribuido a una mejor comprensión de los trastornos fisiopatológicos subyacentes, y permiten anticipar una mejor prevención y un manejo más racional de la población portadora de ERC.
Título: World Kidney Day 2016: averting the legacy of kidney disease-focus on childhood.
Fecha de publicación: 2016 Feb 19.
Este artículo que trata sobre el día mundial del riñón 2016, hace hincapié en la importancia de detectar los factores de riesgo y/o los antecedentes durante la primera infancia para detectar a tiempo los signos tempranos de la nefropatía y así lograr la prevención o el tratamiento eficaces, ya que los niños tienen mejor pronóstico que los adultos si reciben tratamiento renal sustitutivo, incluida la diálisis y el trasplante.
Título: [Infectious complications in children with end-stage renal disease on replacement therapy].
Fecha de publicación: 2015
Este artículo tiene como objetivo estimar la incidencia de complicaciones infecciosas en niños con ERT en terapia sustitutiva.
Métodos: cohorte retrospectiva, se incluyeron pacientes en los programas de diálisis peritoneal y hemodiálisis, con seguimiento mínimo de tres meses.
Conclusión: La mitad de los pacientes tuvieron al menos una complicación infecciosa tanto en hemodiálisis como en diálisis peritoneal. Un poco más elevada en DP.
Título: Can peritoneal dialysis be used in preterm infants with congenital diaphragmatic hernia?
Fecha de publicación: 2013 Feb 11.
Este artículo trata sobre la utilización conéxito de la DP en casos contraindicados como la hernia diafrágmática, si se utiliza con precaución en caso de no poder utilizar otras terapias de reemplazo renales.
Título: Chronic peritoneal dialysis in children with special needs or social disadvantage or both: contraindications are not always contraindications.
Fecha de publicación: 2011 Nov 1.
En este artículo tiene como objetivo el identificar los resultados en niños con necesidades especiales o desventaja social o ambos que reciben tratamiento de diálisis peritoneal crónica (DPC) en una unidad de diálisis pediátrica.
La conclusión establece que con apoyo familiar adecuado y un equipo multidisciplinario experimentado, CPD puede efectivamente realizarse en niños con necesidades especiales o desventaja social o ambos. No tiene por qué ser una contraindicación en el tratamiento.
Título: Acute peritoneal dialysis in the newborn period: a 7-year single-center experience at tertiary neonatal intensive care unit in Turkey.
Fecha de publicación: 2013 Jun 28.
El estudio tiene como objetivo Evaluar las causas subyacentes y los resultados de los neonatos sometidos a diálisis peritoneal aguda (DPA).
La conclusión que se establece es que; la diálisis peritoneal es un medio eficaz de la terapia de reemplazo renal en el período neonatal en el tratamiento de alteraciones metabólicas como la insuficiencia renal. Aunque las principales complicaciones del procedimiento no son tan comunes, estos pacientes tienen altas tasas de mortalidad debido a la gravedad de las causas principales.
Título: Piloting Psychology Annual Reviews as a Method of Measuring Psychological Distress and Quality of Life in Paediatric Renal Transplant Patients.
Fecha de publicación: 2016 Nov 14.
Este artículo trata sobre la alteración de la conducta psicosocial y la peor calidad de vida después del trasplante renal en los niños y jóvenes. Esto a su vez, tiene implicaciones para la supervivencia y el cumplimiento con la medicación.
El objetivo es lograr introducir un servicio de psicología renal, para mejorar el trasplante renal pediátrico y su efecto sobre la calidad de vida.
Título: Niños con enfermedades crónicas: cómo hacer frente a los problemas emocionales y la depresión.
Fecha de publicación: 11/21/2015
Título: Condición física y niños con enfermedades crónicas.
Fecha de publicación: 11/21/2015
Título: Cómo enfrentar sus propias emociones.
Fecha de publicación: 11/21/2015.
Título: Dificultades sociales para niños con enfermedades crónicas.
Fecha de publicación: 11/21/2015
Título: Cómo enfrentar una enfermedad crónica.
Fecha de publicación: 11/21/2015
Los artículos 10, 11, 12, 13 y 14 tienen una temática común. Tratan sobre los aspectos psicosociales tan importantes en una enfermedad crónica y aún más en pediatría.
Las emociones, la depresión, la ira, la desconfianza, el miedo…son sentimientos muchas veces nuevos para ellos (todavía inmaduros) y no saben cómo gestionarlos. La relación con sus compañeros de colegio, de juegos….todo se ve influenciado y se necesita un apoyo familiar, educacional y profesional detrás, para poder superar todas las etapas de la enfermedad de la mejor manera posible.
Todo, enfocado al bienestar y a la mejora de la calidad de vida del niño con ERC y/o con TRS y/o en el proceso de un Trasplante.