

 https://orcid.org/0000-0002-5408-6263
https://orcid.org/0000-0002-5408-6263
La patología del tendón es frecuente en la clínica de fisioterapia actual. Por esta razón, este proyecto de revisión bibliográfica y experiencia profesional surge sobre los principales aspectos del tendón y la recuperación de la lesión del tendón inferior en fisioterapia. El trabajo incluye las secciones de anatomía y estructura del tendón, fisiopatología y carga de trabajo, así como la importancia del dolor en la tendinopatía de las extremidades inferiores. Por otro lado, se tratan aspectos como el examen objetivo y subjetivo en fisioterapia, la aplicación del ejercicio terapéutico y el manejo terapéutico en las principales imágenes clínicas de tendinopatía de las extremidades inferiores: tendón proximal, rótula, aquiles y glúteo medio.
Palabras clave: Tendinopatía, anatomía, carga, biomecánica, fisiopatología, dolor, ejercicios.
Tendon pathology is frequent in current physiotherapy clinic. For this reason, this project of bibliographic review and professional experience arises about the main aspects of the tendon and the recovery of the lower limb tendon injury in physiotherapy. The work includes the sections of tendon anatomy and structure, pathophysiology and workload, as well as the importance of pain in lower extremity tendinopathy. On the other hand, aspects such as objective and subjective examination in physiotherapy, the application of therapeutic exercise and therapeutic management in the main clinical pictures of lower limb tendinopathy are treated: proximal hamstring, patellar, achilles and gluteus medius.
Keywords: Tendinopathy, anatomy, load, biomechanics, pathophysiology, pain, exercises.
La patología tendinosa es frecuente en la clínica actual fisioterápica. Por ello, surge este proyecto de revisión bibliográfica y experiencia profesional acerca de los principales aspectos del tendón y la recuperación de la lesión tendinosa de miembro inferior en fisioterapia. El trabajo recoge los apartados de anatomía y estructura tendinosa, fisiopatología y carga de trabajo, así como importancia del dolor en la tendinopatía de extremidad inferior. Por otra parte, se tratan aspectos tales como el examen objetivo y subjetivo en fisioterapia, la aplicación de ejercicio terapéutico y el manejo terapéutico en los principales cuadros clínicos de tendinopatía de miembro inferior: isquiotibial proximal, patelar, aquílea y de glúteo medio.
Con este proyecto, el objetivo del autor es que tanto terapeuta como paciente puedan aprovechar los conocimientos expuestos en relación con la lesión tendinosa, y se pueda llevar a cabo un óptimo proceso terapéutico para la correcta recuperación y/o readaptación a la actividad deportiva.
El tendón es una estructura de tejido conectivo que conecta el músculo con el hueso. Es capaz de resistir la tensión, y su función es transmitir la fuerza de contracción muscular al hueso para producir movimiento. Sin embargo, no posee propiedades de contractilidad, excitabilidad y tono propias del músculo, aunque comparten las propiedades elásticas. Estos hacen que los músculos se inserten en las piezas óseas esqueléticas, pueden ser principales, accesorios o intermedios, y algunos contienen sinoviales tendinosas y pertitendinosas1.
El primer elemento lo constituye el endotendón, compuesto por fascículos primitivos o primarios, fascículos fibrosos o secundarios y fascículos terciarios. En combinación con los fascículos cuaternarios, surge la estructura del epitendón, a su vez envuelta en el paratendón1. El epitendón cubre todo el tendón y se extiende profundamente, aportando suministro vascular, linfático y nervioso, el endotendón recubre cada fibra del tendón y el paratendón rodea al epitendón, dotando a la estructura de un revestimiento interno de células sinoviales que permiten el deslizamiento del tendón reduciendo las fuerzas de rozamiento2.
El fascículo fibroso primario, en su composición, cuenta con un 95% de sus células como tenoblastos (fibroblastos) y tenocitos (fibrocitos), situados en las superficies de las fibrillas de colágeno, constituyendo las cadenas celulares de Ranvier. El 5% restante sin embargo está conformado por condrocitos (éntesis), sinoviocitos y células vasculares. La matriz extracelular está compuesta por numerosas células como proteoglicanos, glucosaminglicanos, glucoproteínas y otras moléculas2.
Por otra parte, cabe destacar el papel de las vainas sinoviales, ubicadas con frecuencia en zonas de alto estrés mecánico, tales como manos o pies, cuya función consiste en el aumento de la lubricación para permitir el deslizamiento del tendón en estas zonas. Estas vainas van a contar con dos zonas: una vaina fibrótica externa, que es capaz de conformar poleas, condensaciones o fulcros para ayudar a disipar las cargas; y una vaina sinovial interna, una membrana de ultrafiltración que producirá líquido sinovial adecuado a la función del segmento3.
Sin embargo, un elemento fundamental en el campo de la tendinopatía lo constituyen las células tendinosas. Estás se encuentran muy relacionadas con la patología del tendón, su función principal es sintetizar el colágeno y los componentes de la matriz extracelular, aunque también constituyen activos en la generación de energía (ciclo de Krebs, glucólisis anaerobia). Se sitúan entre las fibras de colágeno, y se comunican entre ellas en disposición paralela a lo largo de la dirección principal de la tensión, conformando un elemento eficaz en la detección y respuesta a la carga mecánica4. Un 70% de su constitución lo compone el agua y tenocitos, y un 30% de masa seca (80% colágeno tipo I y 2% elastina) dentro de la MEC. La fibra de colágeno es la unidad tendinosa más pequeña visible en microscopio, organizándose principalmente de forma longitudinal (dirección de la carga), pero también transversal y horizontalmente, formando espirales y trenzas. La molécula de colágeno está compuesta a su vez por cientos de moléculas de tropocolágeno, unidas mediante ``puentes cruzados´´. La cantidad de uniones de este tipo determinará la resistencia y rigidez del colágeno. Esta estructura se caracteriza principalmente por su notable resistencia: una fibra de 1 mm de diámetro puede soportar una carga de 10 a 40 kg3-5.
Cabe destacar una serie de elementos que conforman la matriz extracelular5:
La matriz extracelular experimenta una serie de procesos metabólicos que controlan el equilibrio entre la adaptación fisiológica y patológica de la carga6. Estos procesos van a estar relacionados, por un lado, con el metabolismo y el flujo sanguíneo, y a su vez también con la síntesis de colágeno en tendones (Figura 1).
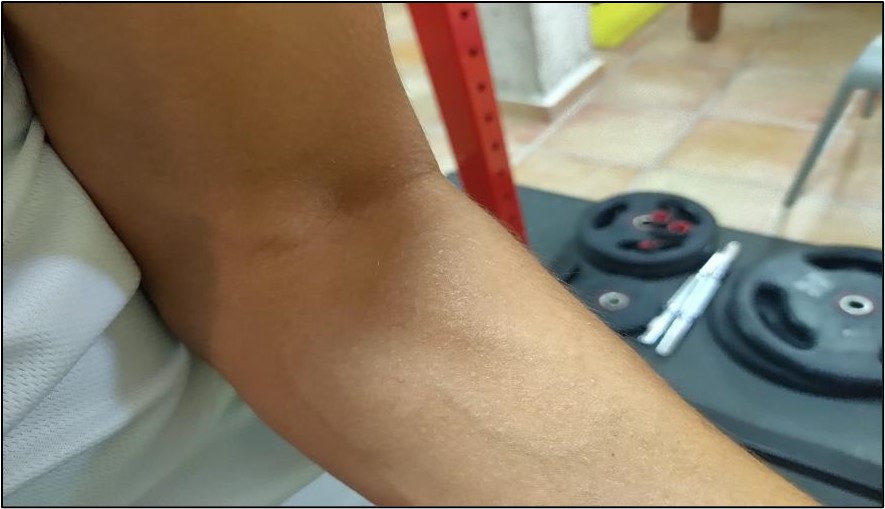
Figura 1. Inserción tendinosa del músculo bíceps braquial.
En cuanto al metabolismo y flujo de sangre, cabe destacar el reducido número de fibroblastos (células residentes) en el tendón y su vaina. No obstante, también hay procesos elevados de comunicación célula-célula entre los fibroblastos, lo que proporciona una base para la existencia de un proceso dinámico entre la MEC y las células6,7. A su vez, también se ha constatado un aumento del flujo sanguíneo de 3 a 7 veces en el tendón con el ejercicio. El flujo sanguíneo en el tendón se ajusta en base a diferentes variables: el ejercicio, por el hecho de constituir una carga mecánica, es capaz de elevar ciertos vasodilatadores en el tejido peritendinoso (bradiquinina, adenosina), elevando las prostaglandinas y el óxido nítrico, así como el factor de crecimiento endotelial (EDHF), elementos importantes en la regulación sanguínea. Es importante remarcar el papel nociceptivo que desempeñan las prostaglandinas en combinación con otras sustancias durante los procesos inflamatorios, capaces de modular el flujo de sangre, por lo que resultaría relativamente contraproducente la aplicación de antiinflamatorios no esteroideos en orden de inhibir la síntesis de prostaglandinas. Tras llevar a cabo una evaluación espectroscópica, no existen signos de desaturación de O2 o manifestaciones de hipoxia pronunciados, aunque sí se ha constatado un aumento de la captación de glucosa tras la ejecución de ejercicio7.
La formación de colágeno en el tendón humano aumenta alrededor del 100% con solo 60 minutos de ejercicio agudo, prolongándose la misma hasta 3 días después. A su vez, también se produce un aumento en la degradación de proteínas, así como la actividad de las MMPasas de forma inmediata tras la finalización del ejercicio. Si estas sesiones de entrenamiento se desarrollan demasiado próximas, es probable que no se obtenga el máximo beneficio de la síntesis de colágeno, entrando en un estado catabólico, pues, aunque el entrenamiento haya cesado, esta degradación de proteínas se reduce lentamente, pero la formación de colágeno permanece alta. La síntesis y degradación de proteínas permanecen altas durante 4 semanas con un entrenamiento continuado, mientras que la formación de colágeno permanece dentro de niveles altos durante 12 semanas con la ejecución pautada de ejercicio de forma prolongada8.
Las dimensiones de los tendones van a influir en la capacidad de estiramiento, así como en la capacidad del tendón y del tejido conjuntivo intramuscular para almacenar y liberar energía elástica durante el movimiento, reduciendo la necesidad total de energía durante la marcha o la carrera. El aumento de la sección transversal del tendón se dará con el entrenamiento crónico, pues estudios actuales hacen referencia a un mínimo de 12 semanas para obtener este tipo de adaptaciones. Por otro lado, un entrenamiento a corto plazo no ha demostrado aumentos en la sección transversal del tendón, es más, incluso tiende a reducirse5,6,8.
Para que la cascada de acontecimientos neurofisiológicos anteriormente expuestos se desarrolle, es fundamental la existencia de un estímulo mecánico que ponga en marcha los procesos mecanobiológicos: la carga. La capacidad de las células tendinosas para detectar y responder a la carga es fundamental para la mecanotransducción y el mantenimiento posterior de la homeostasis. El proceso de mecanotransducción constituye un mecanismo basado en la transmisión de estímulos de presión desde la membrana celular al citoesqueleto, para finalmente culminar en núcleo celular9. Estas señales son capaces de modificar la conformación del citoesqueleto, y aprovechando la transducción pueden inducir en la transcripción génica del núcleo, desembocando en la síntesis de proteínas y regeneración de los tejidos (Figura 2).

Figura 2. Entrenamiento en tendinopatía: flexión concéntrica de cadera y rodilla.
Las células tendinosas son capaces de detectar la carga a través de unos mecanismos sensoriales mecano-electroquímicos que permiten la detección de señales mecánicas gracias a la deformación de la matriz extracelular. Este hecho conduce a la tensión en el citoesqueleto, pudiendo ser detectada por el núcleo celular a través de un sistema de tensegridad mecano-sensorial, y de así producir de esta forma una respuesta al estímulo primario mecánico. En la actualidad, no se conoce el nivel preciso en cuanto a magnitud, frecuencia o duración necesario referente a la estimulación mecano-biológica requerida para mantener la homeostasis del tendón normal9,10.
Los factores de crecimiento y las hormonas están implicados en la regulación de síntesis de matriz extracelular, y aunque se sabe poco de su papel en el ajuste de la síntesis de colágeno, las hormonas TGF1, IGB-beta e IL-6 están presentes en el tendón humano, y su concentración aumenta con el ejercicio, por lo que existe evidencia y razones para considerar su importancia en la síntesis de colágeno. En las mujeres, no obstante, el estrógeno inhibe la síntesis de colágeno y hace que aumente menos con el ejercicio. La expresión del ARN, de colágeno de tipo I y III sigue un patrón muy similar al de la expresión de TGF-B-1 e IGF-1 en ambos tipos de tejidos (músculo y tendón) durante el ejercicio agudo. Estos resultados podrían indicar el efecto producido por la carga mecánica en el tendón y el músculo, capaz de inducir la expresión de colágeno, apoyando así la responsabilidad por parte de la TGF-B-1 y el IGF-1 como mediadores del efecto. También es importante destacar que el tejido del tendón, aunque reacciona a la carga, es menos sensible a las diferencias en el estímulo mecánico (concéntrico, excéntrico o isométrico) en comparación con el músculo esquelético10-12.
Por tanto, considerar la descarga como factor desencadenante de una respuesta totalmente opuesta, como disminución en la expresión de colágeno y factores de crecimiento que inducen colágeno, puede constituir un óptimo punto de partida desde el punto de vista clínico fisioterápico en la construcción de una pauta de ejercicio12. Los efectos de la descarga sobre el tendón y el músculo se resumen en la Tabla 1.
|
Músculo |
Tendón |
|
Disminución del 50% de masa muscular. |
Ausencia de cambios en la masa muscular. |
|
Ausencia de cambios en la expresión de colágeno. |
Ausencia de cambios en la expresión de colágeno. |
|
Aumento elevado en la expresión de colágeno. |
Aumento moderado en la expresión de colágeno. |
Tabla 1. Efectos de la descarga sobre tendón y músculo.
La infra-estimulación mecano-biológica de las células tendinosas también puede producir un patrón de expresión de genes catabólicos que produce una degradación de la matriz extracelular, con su subsiguiente pérdida de material tendinoso. El daño aislado de la fibrilla puede alterar las interacciones normales entre la matriz y la célula, por ello, la incapacidad de las fibrillas para transmitir las cargas de la matriz a las células obtiene como resultado una estimulación insuficiente y el inicio de una respuesta catabólica12,13. Así, el tendón puede aumentar su susceptibilidad al daño asociado a la carga. Por otra parte, cabe considerar la necesidad de una interacción íntima entre la señalización mecánica y los cambios bioquímicos en la matriz del tendón, de modo que los cambios químicos se puedan convertir en adaptaciones en la morfología, estructura y propiedades del material13.
En relación con el tejido muscular, el tendón se encuentra escasamente vascularizado, representando únicamente el 1-2% del total de matriz extracelular. La irrigación del tendón es variable y se divide en tres regiones (unión musculotendinosa, cuerpo del tendón y unión osteotendinosa. El flujo sanguíneo, tras llevar a cabo un entrenamiento físico, es capaz de incrementarse de 3 a 7 veces en comparación con valores normales14.
El peritendón es relativamente avascular, ya que el mayor aporte sanguíneo se suministra a través del perimisio muscular, por medio del paratendón, penetrando en el epitendón, recorriendo el endotendón y construyendo en última instancia la red vascular intratendón.
El tendón cuenta con inervación de troncos nerviosos cutáneos, musculares y peritendinosos, no obstante, la mayoría de las fibras no entran en el cuerpo del tendón, y desembocan en su superficie14,15 (Figura 3). Destacan dos tipos:
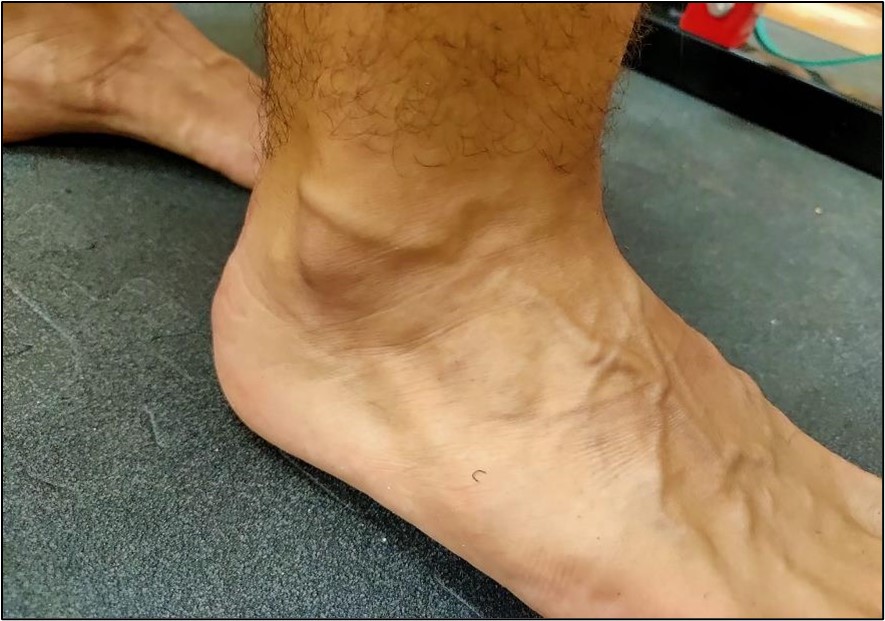
Figura 3. Vascularización en el dorso del pie.
Los tendones son los encargados de actuar como vehículo de transmisión de la fuerza muscular al hueso. En este sentido, poseen la capacidad de almacenamiento y liberación de energía (absorben fuerzas para limitar el daño muscular y reducir la energía necesaria para el movimiento). Los tendones presentan una alta resistencia mecánica, buena flexibilidad y nivel óptimo de elasticidad. A su vez, el comportamiento mecánico del colágeno va a depender de la cantidad y tipos de enlaces intramoleculares e intermoleculares16.
Respecto al colágeno, en reposo cabe destacar en él la presencia de una configuración rizada, que desaparece cuando se le aplica un 2% de tensión, dando lugar a un aplanamiento. También se produce un deslizamiento lineal de las hélices de colágeno intramoleculares, lo que conduce a una transformación de las fibras hasta configurarse de forma paralela. Por debajo del 4% de tensión, el colágeno es capaz de volver a su longitud original, gracias a su componente elástico, mientras que, si se produce una elongación por encima del 4%, pueden constatarse los primeros cambios microscópicos, que resultarían los posibles desencadenantes en los procesos patodegenerativos. Por encima del 8-10% ya se puede constatar un deslizamiento molecular notable17.
Así, la resistencia a la tracción va a guardar una estrecha relación con el grosor y contenido de colágeno. Un ejemplo puede constituirlo un tendón entrenado, donde en un área de 1 centímetro cuadrado es capaz de soportar de 500 a 1000kg durante actividades extenuantes. En este sentido, el tendón de Aquiles es capaz de aguantar 12.5 veces el peso corporal de forma repetitiva durante la carrera, aunque la velocidad también puede desempeñar un papel importante en la ruptura del tendón. Este riesgo aumentará si la tensión se aplica de forma rápida y oblicua, así como a lo largo de contracciones excéntricas, en las que se desencadenan mayores fuerzas15-17.
En tendones propios de animales, el entrenamiento es capaz de constatar mejoras18 en:
Estas respuestas podrían estar propiciadas por un aumento en la síntesis de colágeno y los componentes de la matriz extracelular, por parte de la activación de los tenocitos. Es constatable una mayor proporción de tendones más fuertes en sujetos entrenados en comparación con individuos no entrenados. Las propiedades y funciones del tendón también se deterioran a consecuencia del envejecimiento, dando lugar a una disminución de la cantidad de colágeno y un aumento de la rigidez intrínseca del tendón18. Por otra parte, la inmovilización completa también cuenta con efectos perjudiciales, pues si bien estos cambios ocurren lentamente, el metabolismo lento de los tendones los hace resistentes a los cambios:
Es por ello que el ejercicio constituye un agente fundamental para prevenir los efectos del envejecimiento y la inmovilización en el tendón18.
El tendón, tras experimentar un aumento de la carga basal durante un entrenamiento físico, puede desarrollar adaptaciones tanto en la persona como en el tejido, cambios en las dimensiones y estructura del tendón, en sus propiedades mecánicas y en los niveles de flujo sanguíneo del mismo.
Las adaptaciones surgen debido a la necesidad del tejido de acomodarse y reorganizarse para poder mantener su función principal, por lo que es precisamente la aplicación o ausencia de estímulos mecánicos el factor que determinará la aparición o no de las adaptaciones. Estas a su vez pueden discernirse en dos categorías19:
Una hipótesis situaría un umbral de carga ideal capaz de generar adaptaciones positivas en el tejido sin desencadenar respuestas desadaptativas, en torno al 6% de tensión, por un lado, gracias al aumento de síntesis de ARNm en el colágeno, así como a la inhibición de encimas de degradación (MMPs y colagenasa)20.
Las dimensiones del tendón también se ven modificadas, pues se produce con la carga un aumento en la síntesis de colágeno (aumento de marcadores ARNm de síntesis 24 horas tras el ejercicio y aumento de marcadores de degradación). El aumento del colágeno o la integración del nuevo colágeno parece estar limitado después de la pubertad, mientras que la adaptación basada en el tejido a través de aumentos en las dimensiones del tendón sólo puede ser posible durante la pubertad20,21. Por otro lado, la alta carga mecánica se asocia con un aumento de las dimensiones, pero no está claro cuál es el rango de edad en el que se han generado estos cambios (Figura 4).

Figura 4. Trabajo con goma elástica en tendinopatía.
Por ello, podría resultar lógico pensar que el aumento de la CSA del tendón es una adaptación positiva (mayor tolerancia a la carga), pero no se ha constatado una correlación clara con un menor riesgo de lesión. La pubertad, por otra parte, constituye una ventana de oportunidad, y la inactividad a lo largo de esta etapa puede ser un factor de riesgo para el desarrollo de patología de tendón22. No obstante, la ausencia de cambios en CSA no es significativo en exclusiva de que el tendón no se adapte, pues también existen otros mecanismos.
En las propiedades mecánicas también pueden destacarse ciertos cambios, frecuentemente en las zonas de aponeurosis muscular, sin ser capaces de transferirse al tendón. La secuencia temporal en este caso es fundamental, pues podría condicionar la aparición de patología y dolor, propiciar una disminución de la rigidez post-ejercicio y desarrollar programas de carga a medio largo plazo, aumentando la rigidez. No existe una gran cantidad de estudios que vinculen las adaptaciones en propiedades mecánicas con la mejora en el rendimiento (adaptación persona frente al tejido), sin embargo, sí podría optimizar la capacidad de transmitir fuerza, y podría presentar una correlación positiva con la altura en el salto vertical. La rigidez o flexibilidad ideales van a depender de la tarea específica, pues en este sentido un saltador o corredor de larga distancia no van a precisar de unas mismas propiedades para desarrollar su actividad22,23.
La estructura interna del tendón también puede sufrir modificaciones, aunque se desconoce el tipo de proteínas involucradas (proteoglicanos, colágeno, etc.). En este caso el individuo debe someterse a estudios de imagen ``in vivo´´, comprobando como la adaptación de la estructura interna del tendón podría constituir un cambio desadaptativo (aumento de grandes proteoglicanos), aunque existen diversas teorías. Se han constatado ciertas mejoras en el patrón ecoUTC tras exposiciones prolongadas a cargas (3-5 meses) en tendones sanos. La capacidad de carga no está relacionada con la presencia o extensión de la patología, el rendimiento en este caso es equivalente en tendones sanos y patológicos sin clínica, pues un tendón con cambios significativos rara vez recuperará su estructura normal23.
En cuanto al flujo sanguíneo, se constata un aumento en el volumen vascular después de una carrera de 1 hora, normalizándose a valores normales en 24 horas. Los cambios en el flujo no se han visto afectados por la presencia de patología o dolor, aunque tradicionalmente se les ha considerado como una respuesta desadaptativa23.
Se entiende por tendinopatía a los cambios que ocurren en la estructura del tendón que afectan a su capacidad de carga (detección, tolerancia y adaptación). Los factores clave para desencadenar la respuesta patológica son los mecanismos de almacenamiento y liberación de energía (sobrecarga tensil) de forma repetitiva junto a las fuerzas de compresión del tendón. La incidencia de las tendinopatías aquilea y rotuliana son las más frecuentes.
Se desarrolló el concepto actual del Modelo continuum, diferenciado de otras propuestas anteriores por su visión de cambio continuo de la estructura patológica del tendón. Así pues, cada fase tiene una presentación clínica característica y un tratamiento específico. Según este modelo se describieron tres fases bien diferenciadas: tendón reactivo, tendón desestructurado y tendón degenerado (dentro de esta tercera fase también se podría dar una fase reactiva). Sin embargo, aunque se presenten como fases continuadas del proceso patológico, en un mismo tendón podríamos encontrar diferentes fases24.
La patología del tendón se cree que se produce a partir de una respuesta primaria de las células tendinosas a una sobrecarga, si bien, una infraestimulación o infracarga también podría desencadenar respuestas patológicas. En este sentido, lo primero que tiene lugar en el proceso patológico es una actividad y proliferación celular aumentada en el tendón, después comienza el aumento de los proteoglicanos grandes, posteriormente una desorganización de la matriz extracelular y del colágeno y, por último, un aumento de la vascularización. A nivel bioquímico, también se producen cambios de los mediadores inflamatorios (sustancia P y prostaglandinas), aunque realmente la patología tendinosa no es una patología inflamatoria y, los biomarcadores inflamatorios se utilizan como comunicación celular fundamentalmente24.
En los tendones hay una población de células residentes capaces de diferenciarse tras la lesión: osteoblastos, condrocitos, adipocitos y tenocitos. En tendones sometidos a una carga aumentada podemos encontrar una proliferación de este tipo de células y producirse una metaplasia o más comúnmente conocida como calcificación. Realmente esto ocurre en numerosos tendones, pero la mayoría no son perceptibles a nivel de imagen excepto las osificaciones muy grandes. En la mayoría de los casos no suelen ser dolorosas, únicamente autores han evidenciado que durante la reabsorción de los cristales de calcio se pueden dar periodos de dolor muy agudo y de corta duración en el tiempo, a diferencia de las tendinopatías que se caracterizan por el dolor durante largos periodos de tiempo. De este modo, no se podría correlacionar el dolor de las calcificaciones con el de las tendinopatías24.
La importancia que se debe dar, pues, a las calcificaciones es simplemente que, si encontramos grandes calcificaciones en el tendón, hay que tener en cuenta que ese tendón está sufriendo unas cargas a las que no está adaptado y, que probablemente tenga menos tejido disponible para tolerarlas, por lo tanto, estaría indicado actuar como en una tendinopatía normal adaptando la tolerancia a las cargas25.
La primera fase del Modelo continuum es la del tendón reactivo. Es una fase que ocurre cuando hay un aumento repentino de la carga (Figura 5).
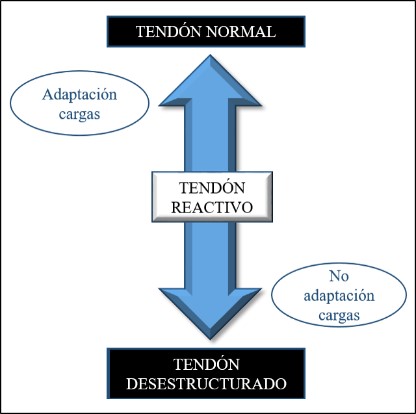
Figura 5. Fase de tendón reactivo.
Los tenocitos identifican el cambio en la carga y responden de manera adecuada, aunque debido al metabolismo lento de estas células la adaptación del tendón es lenta y, especialmente si el cambio en la carga se produce de manera rápida.
Microscópicamente las células tendinosas van a iniciar una respuesta de hiperactividad celular, con un aumento drástico del número de células y lo más importante, un aumento de los proteoglicanos grandes (agrecano). Se trata de moléculas hidrófilas que atraen el agua a la matriz extracelular y hacen que el tendón se engrose, esto puede hacer que las fibras tipo C se sensibilicen y se produzca dolor. En la matriz extracelular no van a haber cambios25.
Macroscópicamente se observa un aumento de la sección transversal del tendón, que tendrá el potencial de volver a su estado normal siempre que se adapten las cargas. Por el contrario, si el tendón se sigue exponiendo a las mismas cargas, podría seguir este proceso continuado y entrar en la fase 2 de tendón desestructurado.
La segunda fase del Modelo continuum es la del tendón desestructurado. Es una fase en la que la recuperación del tendón reactivo ha fallado, la balanza se ha inclinado en favor de la degradación del colágeno y la matriz extracelular se ha desorganizado cambiando la composición del tendón26.
Es una fase asintomática, va a doler únicamente cuando haya un cambio en la carga y pueda haber de nuevo una fase reactiva. Se trata de este modo de una tendinosis y no de una tendinopatía, por ello es poco frecuente que un paciente nos llegue en esta fase al no presentar dolor. En este sentido, esta fase solo es reconocible en imagen ya que no suele verse en clínica.
Esta fase conlleva el desarrollo y progresión de la desestructuración fibrilar, sigue aumentando el número de células tendinosas debido a que las comunicaciones entre células no van a ser adecuadas. También, se mantiene el aumento de los proteoglicanos y la producción de colágeno (Figura 6). Por todo ello, en imagen se puede seguir viendo un tendón más grueso e hipoecoico (oscuro) y, por último, comenzará el inicio de la separación del colágeno, haciendo mucho más difícil la comunicación entre células26.
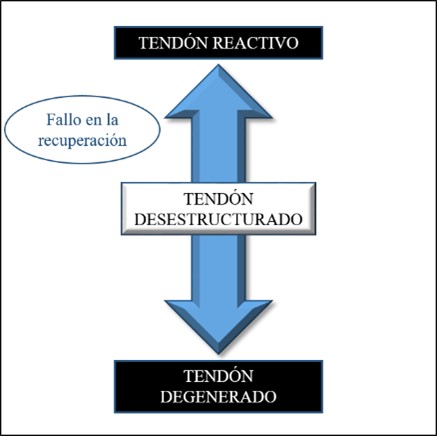
Figura 6. Fase de tendón desestructurado.
Macroscópicamente en imagen no se observarán cambios en la vascularización, sino una desestructuración en la matriz o discontinuidad del colágeno y áreas hipoecoicas. Es importante no confundir dichas áreas hipoecoicas con roturas intratendón o parciales, pues no son diagnosticables mediante ecografía ni resonancia, además de que son realmente raras. Únicamente con ecografía de caracterización del tejido, autores como Cook en toda su carrera usando esta técnica solo han encontrado dos o tres pacientes con este tipo de patología.
Lo que ocurre es que el colágeno se desorganiza y no se encuentra uniforme en todo el tendón, habiendo zonas con y sin colágeno, en las zonas hipoecoicas lo que encontraremos principalmente serán células tendinosas, agua o proteoglicanos y, por esta razón estas zonas se verán negras al no rebotar las ondas del ultrasonido, y no porque haya una discontinuidad del tejido o rotura intratendón25,26.
La tercera y última fase del Modelo continuum es la tendinopatía degenerativa que tiene lugar si se continua con el proceso de degeneración. Esta fase va a ser la más importante a la hora del dolor del paciente.
En esta fase ocurre una progresión de la desorganización de la matriz extracelular y el colágeno, cambios en la función y estructura de las células, se vuelven más planas y afecta a la capacidad de detectar la carga y a la producción de dolor tendinoso. Además, es el momento en el que aparece la neovascularización, aunque no se ha demostrado que la misma, esté directamente relacionada con el dolor del tendón. Los nervios que llevan los vasos sanguíneos tendinosos son simpáticos, no son nervios conductores de nocicepción. También encontramos áreas de muerte celular, las células se comunican entre sí y uno de los mensajes que pueden dar es el de la apoptosis27. Este proceso no va a ser reversible, un tendón degenerado lo será siempre, pero esto no quiere decir que los tendones no puedan ser capaces de adaptarse a la carga, pueden tener la misma cantidad o incluso más cantidad de tejido sano que un tendón normal, lo cual se ha comprobado con ecografía de caracterización del tejido.
Macroscópicamente veremos imágenes hipoecoicas y tendones de gran tamaño con neovascularización.
Lo que sabemos según la evidencia es que el tendón degenerado podría adaptarse aumentando su tamaño y asegurándose suficientes zonas de tejido sano para compensar el área desorganizada. La zona degenerada es mecánicamente inservible esto quiere decir que aparte de que no va a tener propiedades mecánicas (volverse más rígido, flexible, adaptarse), tampoco va a ser capaz ni de detectar cargas ni de responder a ellas, pues son células muertas y todos los procesos se van a dar en el tejido sano27 (Figura 7).
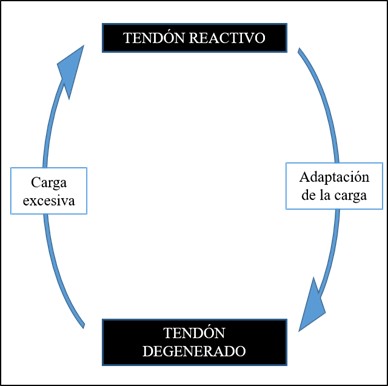
Figura 7. Ciclo reacción-degeneración.
El tendón engrosado es una adaptación positiva de la zona degenerada para poder hacer frente a cargas tensiles, por aumento de la cantidad de proteoglicanos. El tendón degenerado no presenta clínica hasta que es sometido a una carga excesiva, es el área sana donde se va a presentar la zona reactiva y, por lo tanto, donde se va a provocar el dolor. Solamente podrá responder a la carga el tejido sano del tendón por lo que es el área que hay que intentar que mejore su tolerancia a las cargas.
El 97% de las roturas tendinosas experimentan cambios degenerativos, pero no dolor, si el paciente tiene dolor probablemente es muy difícil que se rompa, los tendones que se rompen son tendones asintomáticos donde el dolor no ha jugado el papel biológico de defensa.
En el tratamiento de las tendinopatías degenerativas debemos tratar por todo lo anteriormente descrito la zona de tendón sano, y no tratar de mejorar la zona degenerada ya que no se puede generar ningún cambio al no haber células disponibles (Figura 8). Esto solo puede conseguirse con el ejercicio, para exponer al tendón a cargas mecánicas y mejorar su tolerancia a ellas y, con ello poder recuperarse del proceso patológico del tendón26-28.
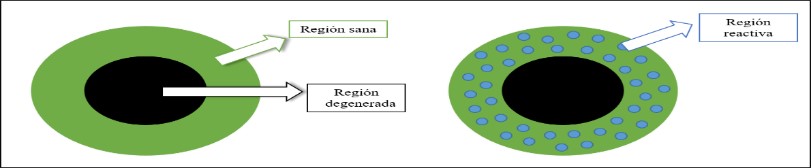
Figura 8. Las regiones del tendón y su implicación clínica.
Una característica de este tipo de dolor lo constituye la variabilidad en su forma de presentación, lo que sumado a una ausencia de mecanismo claro para explicarlo puede llevar a un aumento en la dificultad del abordaje fisioterápico clínico de este tipo de pacientes. Esta condición es a menudo persistente, constatándose una ausencia de correlación entre el daño tisular observado en la imagen y la clínica. Es por ello, que las características álgicas en este tipo de tejido suelen ser relativamente diferentes a otras condiciones de dolor crónico29.
Es frecuente su presentación clínica como dolor localizado en el tendón, que se reproduce con carga, provoca una alteración de la función y es sensible a la palpación. El dolor en este caso define la presentación clínica, independientemente del grado de patología. No obstante, estudios de imagen previos demuestran la existencia de cambios estructurales propios de la tendinosis en tendones completamente asintomáticos. Es por ello que la tendinosis a veces es descrita como un hallazgo accidental en el examen, y no constituye en sí misma el diagnóstico de tendinopatía, que requiere de síntomas clínicos. Esta condición se relaciona de forma directa con la carga, cuenta con una naturaleza transitoria en patrón on / off, siendo extraña su dolencia en reposo o en actividades de baja carga29. El tendón puede ``calentarse´´ en el transcurso de una actividad y volverse menos doloroso, para volverse tanto o más doloroso que al comienzo momentos después del ejercicio.
Existen dos perspectivas a la hora de analizar la naturaleza del dolor en tendinopatías:
Figura 9. Daño tisular en tendón de Aquiles.
Otros aspectos pueden estar mayormente vinculados con un dolor fisiológico, tales como dolor confinado en el tendón y asociado temporalmente con la carga. Una presentación clínica que no se explica por ninguna de las clasificaciones es la ruptura del tendón, pues los tendones que llegan hasta ese estado de gravedad presentan un estado previo patológico, pero en ausencia de dolor, por lo que en este caso la entrada nociceptiva pudo haber sido ventajosa31.
La nocicepción no es suficiente ni necesaria para el dolor, pues por nocicepción se considera a la actividad de los nociceptores aferentes primarios (fibras C no mielinizadas y fibras a delta mielinizadas) y sus proyecciones a la corteza a través del tracto espinotalámico lateral. Las proyecciones van a culminar en múltiples regiones, pero predominantemente van a llegar al tálamo, que se encargará de transmitir impulsos en dirección a la corteza somatosensorial. Estos nociceptores pueden responder a estímulos térmicos, mecánicos o químicos. Es por ello que el dolor puede abordarse como una propiedad emergente de la persona con dolor, desencadenado con mayor frecuencia por la entrada nociceptiva, pero capaz de ser evocado sin activar los nociceptores y modulado por una serie de factores contextuales y cognitivos30-32. La relación entre nocicepción y dolor se vuelve más tenue a medida que el dolor persiste. La tendinopatía cuenta con ciertas características propias de la sensibilización central, siempre y cuando se contemple la sensibilización como una regulación al alza entre el estímulo y la respuesta. De esta forma, el dolor es evocado por estímulos que normalmente no lo desencadenan (alodinia), y los que normalmente despiertan este dolor, lo producen en mayor medida (hiperalgesia). Un ejemplo puede ser la ejecución de ejercicios que no suelen provocar dolor y así lo desencadenan, como saltos o combinación de tareas de miembro inferior (alodinia). Por otro lado, si la palpación del tendón de Aquiles despierta un dolor desproporcionado en comparación con los umbrales habituales, cabe destacar la presencia de hiperalgesia primaria. En el tendón vamos a constatar hiperalgesia y alodinia primarias, no secundarias, pues para constituirlo, estas deberían atribuirse a la sensibilización de las neuronas nociceptivas dentro del sistema nervioso central. Esta observación implica de forma razonable que el tejido del tendón o los nociceptores primarios que lo inervan son el conductor nociceptivo del dolor31,32.
Por ello, el hecho de la persistencia del dolor en la tendinopatía podría asociarse con posibles contribuciones centrales capaces de promover la cronicidad, pero no manifestarse en la hiperalgesia secundaria. Así, cabe destacar que la hiperalgesia primaria no se correlaciona con la función32.
Se produce un aumento en la producción de proteoglicanos grandes, un compromiso de la adhesión celular, una migración y proliferación, una interferencia en la relación célula – matriz extracelular y un aumento de la cantidad de agua, produciéndose una hinchazón del tendón33:
Se produce un aumento de la vascularización, debido por un lado a la angiogénesis, así como gracias al incremento de flujo sanguíneo. No obstante, la neovascularización se asocia a tendinopatía degenerativa, pero no así con tendinopatía temprana. No todos los tendones dolorosos tienen neovascularización, vasos, nervios y receptores en sus paredes no explican el dolor en sus diferentes presentaciones clínicas33.
Responden a cambios en su entorno mecánico, iónico y osmótico. Es en la tendinopatía donde proliferan, se vuelven redondeados y con más orgánulos productores de proteínas, modificaciones que incrementan la producción de sustancias y receptores participantes en la nocicepción. También pueden alterar la comunicación celular y la mecanotransducción, así como cambios en la homeostasis del tendón33,34.
Ninguno de los cambios bioquímicos puede explicar el dolor en la tendinopatía, pero si pueden desempeñar un papel importante. Los tenocitos también pueden producir neuropéptidos (Sustancia P) y neurotransmisores, aunque el dolor también se encuentra mediado por sustancias cuyos efectos son pro y antiinflamatorios33:
Estas sustancias pueden participar en funciones tales como la comunicación celular, la proliferación y apoptosis, vasodilatación, metabolismo celular /de matriz extracelular, facilitación del comportamiento nociceptivo o producción de colágeno.
Las células y tejidos requieren del mantenimiento del PH intracelular y tisular, sin embargo, muchos procesos y proteínas sólo se dan dentro de rangos de PH específicos. El potencial de membrana (diferencia de PH entre interior y exterior de la célula) determina la excitabilidad de la célula y está influenciado por el PH del entorno. El lactato se correlaciona con la disminución del PH, pues en tendinopatías los niveles de este componente suelen dispararse hasta el doble que en individuos sanos. El aumento de lactato debido a un metabolismo anaeróbico predominante, ocurre tanto en personas mayores como en tendinopatías33. Éste se ve agravado por la alta tasa metabólica (25 veces mayor en tendinopatías). El ácido láctico se disocia en lactato y iones de H, estos últimos, modulan la actividad nociceptiva y alteran la expresión del canal iónico. Se ha asociado con dolor en otros tejidos como el disco, el músculo cardíaco y el esquelético. Es por ello que el lactato constituye un metabolito muy activo, capaz de participar en diferentes procesos:
Algunas características del dolor corresponden a la clínica resultante del lactato acumulado. Por ello, se produce un alivio rápido tras un cambio de postura (posturas mantenidas son dolorosas en tendinopatías). Existe una mala respuesta a los antiinflamatorios, sin embargo, existen otra serie de tendinopatías concretas que requieren de una explicación adicional, como la disminución del dolor con la actividad33.
Estas estructuras se ubican en las membranas celulares, permitiendo una alteración en el flujo de iones dentro y fuera de la célula y respondiendo al voltaje, el movimiento y los productos químicos. Son importantes en el dolor tendinoso debido a varias razones: participan en la detección de estímulos nociceptivos, en la comunicación con los nervios aferentes, en la transmisión neuronal hacia la corteza y en la conversión de una fuerza o carga en un potencial de acción relativo a un nervio. Los canales iónicos a menudo se encuentran conectados al citoesqueleto y a estructuras extracelulares (proteoglicanos), lo que les conlleva a un bloqueo por deformación mecánica, y existe una alta probabilidad de que se vean modificados por un cambio en la forma de los tenocitos34.
También es posible que la expresión de los canales iónicos cambie en un ambiente más ácido debido a un exceso de lactato, por lo que al disminuir el PH se produce un aumento de canales iónicos acidificantes (ASIC). Estos últimos se activan rápidamente en presencia de hidrógeno y se desactivan rápidamente a pesar de la presencia del lactato, debido al fenómeno de saturación. En otros tejidos como el hueso, un ambiente ácido impide la actividad de los osteocitos, por lo que los ASIC tienen un papel que pasa no sólo por la nocicepción, sino también por tareas de actividad celular. En este sentido, cabe pensar que los canales iónicos activados por estiramiento (SAC) u otros activados mecánicamente pueden estar implicados en la detección y transmisión de la nocicepción. La actividad de los SAC es dependiente de la carga, pues el dolor se vuelve más intenso con la carga incrementada, y también se correlaciona con el fenómeno de calentamiento, que corresponde con el período de saturación de estos canales iónicos34,35. En los nervios, la expresión de los canales iónicos también puede cambiar en respuesta a la activación repetida, produciendo una sensibilización de la neurona primaria al estímulo que evocó el ajuste.
El ambiente del tendón puede volverse ácido en los tendones, a niveles que incluso pueden permitir una apertura de los ASIC expresados por tenocitos o neuronas. La desensibilización puede producirse tras la estimulación persistente de ASIC durante al menos 3 minutos, uno d ellos detalles que permitirían responder al fenómeno de calentamiento. No obstante, esta recuperación de desensibilización ocurre lentamente, alargándose incluso horas, hecho que corresponde con la presencia de dolor y rigidez posteriores35. También estas estructuras se ajustan a la activación-desactivación del tendón (Figura 10).
Figura 10. Coacción agonista-antagonista en tendinopatía isquiosural.
Es por ello que el dolor en los tendones puede constituir el resultado combinado de todos estos cambios, a nivel de estructura, niveles bioquímicos y función celular. En la tendinopatía reactiva puede haber una mayor expresión de sustancias nociceptivas debido a los cambios en la proliferación y activación celular, pero no así cambios en la inervación. Por otro lado, en la degenerativa podría no constatarse una expresión clara de sustancias nociceptivas (inactivación o muerte celular), pero sí cambios en la inervación. Incluso puede darse el caso de tendones sin dolor con una gran desorganización de la MEC, pero con producción insuficiente de sustancias nociceptivas o insuficientes cambios neuronales para alcanzar un umbral35.
En relación con los mecanismos centrales, pocos estudios han examinado los procesos de sensibilización central en tendinopatía, o si estos están involucrados en ella. Un dolor por tendinopatía parece un dolor crónico único, pues se trata de un dolor que ocurre durante la carga, aumentando conforme aumenta la misma y desapareciendo cuando se reduce. No es constatable tampoco una respuesta exagerada de dolor como característica clínica de las tendinopatías, y la naturaleza on / off reduce la posibilidad de potenciación a largo plazo. Por otra parte, la diseminación no es una característica clínica de las tendinopatías, aunque la aparición de síntomas en el lado contralateral sí. Este hecho suele atribuirse a patrones de carga contralaterales, aunque los mecanismos neuroinmunes del sistema nervioso central ofrecen una explicación relativamente factible. El 6% de los pacientes con tendinopatía de Aquiles han presentado una rotura del tendón contralateral, lo que podría explicarse por altas cargas bilaterales, factores centrales o incluso factores sistémicos o genéticos35. Por ello, es razonable pensar que la frecuencia de entrada de estímulos no sólo está relacionada con las adaptaciones locales del tendón (producción de colágeno o respuestas celulares locales), sino también con la sensibilidad de la vía: aumento de sensibilidad mecánica, hiperalgesia y cambios bilaterales en umbrales por presión y cambios bilaterales en sensibilidad térmica. Investigaciones en un futuro deberían analizar la existencia o no de mecanismos no nociceptivos que desempeñen un papel en el dolor tendinoso, así como en el cálculo interno de la carga del tendón y el papel del dolor como responsable de un error de este cálculo de carga.
Los principios del manejo en la tendinopatía se fundamentan en la educación, el monitoreo, el manejo de cargas, el empleo del ejercicio terapéutico y la combinación con intervenciones complementarias.
La educación constituye una herramienta fundamental a la hora de gestionar las expectativas de una solución rápida, así como para aliviar la ansiedad que pueda producir el hallazgo de estructuras patológicas en la imagen, o la facilitación de la adherencia. Es por ello importante informar sobre la posibilidad de sentir dolor en el proceso de rehabilitación, haciendo hincapié en la necesidad de manejar las molestias en rangos controlados, así como eliminar la confusión generada debido a la gran cantidad de opciones disponibles, destacando el empleo de ejercicio como piedra angular durante el tratamiento36.
Es preciso hacer hincapié en el hecho de que el dolor no equivale siempre a un daño real, y que se relaciona en la mayoría de los casos con la tolerancia del tendón a la carga. Es únicamente el ejercicio el que puede mejorar la tolerancia del tendón, en especial ejercicios con cargas altas y rápidas frente a cargas bajas y lentas. El ejercicio puede despertar molestias, siempre y cuando las mismas sean aceptables y la recuperación a las 24 horas sea completa, valorando en un entorno clínico el empleo expresiones tales como degeneración severa, rotura parcial o inestabilidad. Es por ello que la patología constituye un hecho común en personas a priori sanas, que no presentan dolor, y por ello peor patología tampoco puede asociarse con una recuperación más compleja. El dolor y la función van a mejorar de forma independiente al estado del tejido, generalmente, por lo que las diferencias estructurales no pueden constituir un obstáculo a la hora de progresar en la intervención. Es por ello que la terapia por ejercicio constituye la piedra angular del tratamiento en las últimas tres décadas, siempre estableciendo objetivos concisos al comienzo de la rehabilitación, en términos de necesidades funcionales del paciente. Es preferible comenzar en gran parte de los casos con un programa conservador, pues los resultados de la cirugía en tendinopatías resultan muy poco alentadores, a excepción de un alargamiento en el tendón del tibial posterior o una rotura completa de tendón. Así, el reposo completo también está contraindicado, pues disminuye la potencia muscular, reduce las propiedades mecánicas del tendón, afecta a la cadena cinética y provoca cambios en el impulso a la corteza (hiperexcitación e hiperinhibición)36.
Es por ello fundamental identificar volúmenes y tipos de carga que desencadenan el dolor, pues a menudo resultarán ser cargas de almacenamiento de energía no habituales, o bien cargas de compresión. Los pacientes, frecuentemente se exponen a ellas demasiado rápido (sin apenas tiempo de adaptación), por lo que deben reducirse en un entorno deportivo, negociando con el atleta o el propio equipo, así como la puesta en escena de cambios y modificaciones en las actividades diarias. Para gestionar la carga puede emplearse el monitoreo diario a través de escalas numéricas de dolor aplicadas en la prueba de carga. Es muy importante cuantificar la respuesta a la carga a las 24 horas posteriores a su finalización, y las mismas deben incrementarse gradualmente para aumentar la capacidad del tendón. Una herramienta eficaz lo constituye el cuestionario VISA, validado para la tendinopatía de Aquiles, rotuliano, isquiotibiales y glúteos, más adecuado cuando se pone a prueba de forma mensual. La tolerancia al dolor en tendinopatías se expresa con el ``Modelo de las Montañas Rusas´´, en el que se aprecia la disminución de la tolerancia hasta llegar al momento lesional más álgido, para después ir aumentando la capacidad de tolerancia de forma progresiva hasta la recuperación post-lesión36.
A la hora de disminuir la carga no tolerable, podemos disminuir el dolor mediante isométricos, cuya eficacia ha sido demostrada en comparación con la contracción isotónica (tendón rotuliano). Por ello, a la hora de controlar el dolor existe un orden de prioridades36,37:
Si bien el ejercicio no constituye la única alternativa terapéutica en el manejo de tendinopatía, sí resulta el abordaje con más evidencia. No obstante, las tasas de éxito reportadas de programas de ejercicio en tendinopatía de Aquiles varían de entre el 56% al 94%, cuyos resultados indican como intervenciones de carga muy diferentes producen resultados clínicos similares a largo plazo. No existe un beneficio adicional del ejercicio de control motor específico frente a cualquier otro ejercicio más genérico en el dolor lumbar, afirmación respaldada por la hipótesis que defiende el aumento de tolerancia al ejercicio y a la carga de cualquier intervención mediante entrenamiento físico (Figura 11). Los mecanismos del ejercicio en la tendinopatía se centran en el modelo explicativo muscular y tendinoso, pero la disfunción muscular y la patología tendinosa puede permanecer incluso después de la resolución de los síntomas. Los mecanismos no tisulares, como la reducción del miedo y aumento de la autoeficacia pueden constituir pilares fundamentales en la literatura actual en tendinopatía. No obstante, no se deberían abandonar el abordaje desde el mecanismo tisular hasta ampliar el conocimiento y relación dosis-respuesta. El tiempo bajo tensión y la intensidad de la carga son factores clave tanto para el músculo como para la adaptación del tendón36-38.

Figura 11. Trabajo de abducción-aducción en tendinopatía de aductores.
Desde hace décadas, el ejercicio excéntrico ha sido empleado como pilar fundamental en el ejercicio terapéutico durante el proceso de rehabilitación. La evidencia es inconclusa, y no demuestra pruebas suficientes para respaldar este tipo de ejercicios frente a otros programas de carga. Una nueva alternativa pasa por los HSR (ejercicios pesados de resistencia lenta), con el objetivo de inducir la síntesis de colágeno y mejorar la rigidez mecánica del tendón. Su eficacia es similar a los excéntricos en tendones como Aquiles, y la satisfacción es mayor parte de los pacientes a los 6 meses39.
Tanto ejercicios isotónicos como isométricos son capaces de reducir el dolor, aunque los isométricos son capaces de extender esta reducción durante más de 45 minutos. También se ha descrito un mayor grado de mejoría para los puntajes de dolor a las 4 semanas, al igual que un mayor beneficio por parte de los mismos en cuanto a analgesia inmediata frente a ejercicios pesados de alta resistencia, aspecto útil antes de la competición39.
Ejercicio y cambios estructurales
Cabe destacar la existencia de pruebas contradictorias en relación con la asociación entre función y cambio estructural después del ejercicio. Pueden constatarse pruebas sólidas que sugieren una ausencia de asociación entre la mejora de la función y la reducción en el diámetro (Exc.), una evidencia moderada acerca de la relación entre mejora en la función y reducción en el diámetro (HSR), una evidencia sólida de ausencia de asociación entre mejora de la función y mejora en neovascularización (Exc.), evidencia moderada entre mejora de función y mejora de neovascularización (HSR) y una fuerte evidencia entre la ausencia de relación entre mejora en la función y reducción de anormalidades estructurales39.
En cuanto al área de sección transversal: evidencia contradictoria apoyada en estudios de baja calidad acerca de la asociación de reducción del diámetro del tendón y reducción del dolor (MedRrex), evidencia limitada de muy baja calidad que asocia reducción del dolor con reducción del volumen del tendón (Exc.) así como aumento del área de sección transversal y disminución del dolor, a corto y largo plazo (HSR).
En relación con las anomalías estructurales, existe evidencia contradictoria que sugiere que una reducción del dolor se asocia con una reducción de las anomalías (HSR). Por otra parte, también existen pruebas sólidas de la ausencia de relación entre reducción del dolor y reducción de la neovascularización39 (Exc.).
Período 1: Ejercicio isométrico
Período 2: Ejercicio isotónico lento de alta carga
Período 3: Trabajo de velocidad y almacenamiento de energía
Período 4: Trabajo de almacenamiento y liberación de energía, entrenamiento específico
Figura 12. Farmacología empleada con frecuencia en tendinopatía.
En la investigación en tendones la fuerza muscular está representada por la contracción voluntaria máxima (CVM). No existe un patrón consistente de cambio en la fuerza / rendimiento en los tendones estudiados (o en los contralaterales). Clínicamente tenemos la percepción de que el dolor provoca pérdida de fuerza. Por ello, en personas con tendinopatía del manguito rotador han demostrado ser un 15% más fuertes en la ABD en su lado asintomático que los controles, al igual que en casos de epicondilalgia lateral41.
Así, atletas con tendinopatía patelar, son mejores saltadores que atletas sanos, pues varios trabajos previos reportan menor fuerza en el lado sintomático que los controles, describiéndose una mayor inhibición cortical en respuestas del cuádriceps, asociada a estímulos nociceptivos fásicos como la aplicación de carga. También se constata una mayor excitabilidad corticoespinal que en los controles, con diferencias en el equilibrio excitabilidad /inhibición del CM.
Puede que las diferencias en la reorganización de la corteza somatosensorial primaria y la corteza motora primaria (M1) sean diferentes en la extremidad superior e inferior. El papel de la extremidad superior se relaciona con la posición y el control de la mano en el espacio, pues la misma cuenta con una gran representatividad en la corteza somatosensorial y M1. Es por ello que las consecuencias asociadas a la cronicidad en procesos tendinosos, pueden ser diferentes en EESS frente a EEII. Es probable que los saltadores más talentosos jueguen en posiciones que requieren más saltos, por lo que también cabe esperar un mayor grado de fuerza en la extremidad dominante, y que la misma sea más vulnerable al dolor41.
La fuerza es una cualidad dependiente de factores cognitivos / motivacionales, y la contracción voluntaria máxima no va a reflejar la interacción compleja entre influencias excitadores e inhibidores en el comando motor. Tampoco proporciona suficientes detalles sobre la carga en el tendón en niveles submáximos, por lo que no que tampoco es capaz de calificar el reclutamiento muscular o los patrones de activación. El lado asintomático contralateral es más débil en tendinopatía de miembros superiores, por lo que parece que el cambio en el control motor puede ocurrir bilateralmente, y una vez instaurado el dolor en un lado, el riesgo de tendinopatía bilateral aumenta. Este hecho puede comprobarse tras el análisis de datos de deportistas con patrones de uso unilaterales (lanzadores de béisbol), demostrando a su vez cambios de forma bilateral. Las vías potenciales para la explicación de estos cambios bilaterales pueden explicarse por las conexiones interhemisféricas, así como por la modulación / sensibilización medular. El proceso puede ser similar al ocurrido en el caso de un accidente cerebrovascular, con mayor inhibición en el lado afecto, aumento de la excitabilidad corticoespinal en la extremidad contralateral e inhibición interhemisférica desde el hemisferio no afecto al afecto42.
Si tenemos en cuenta que el dolor, definitivamente, es capaz de cambiar la función muscular funcional (Figura 13), un objetivo terapéutico es poder actuar a nivel central empleando ejercicio y poder revertir los cambios relacionados con la sensibilización durante la aplicación de carga.
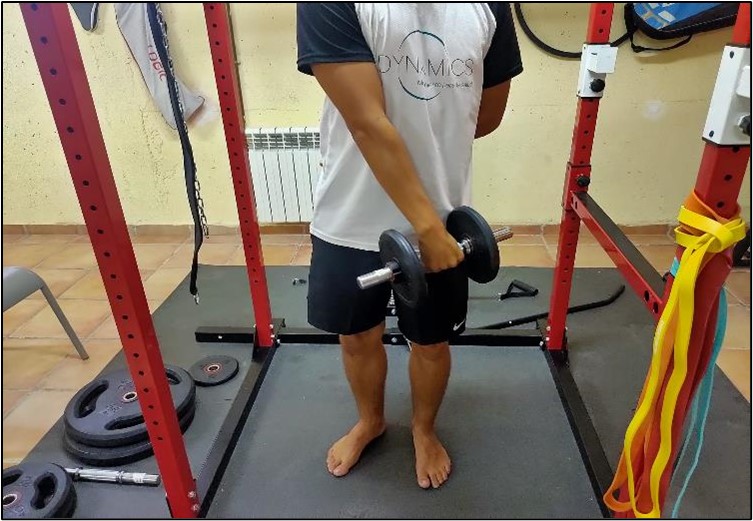
Figura 13. Entrenamiento en patrón funcional diagonal.
La activación muscular implica la activación de amplias regiones corticales y subcorticales, por lo que convencionalmente se recomiendan ejercicios de fuerza a ritmo propio (3 x 10), en ausencia de estímulos externos (ya sean visuales o auditivos). Otros estudios que han empleado estímulos externos han demostrado poseer capacidad para inducir cambios ipsilaterales y contralaterales en la excitabilidad e inhibición42.
La rehabilitación en la actualidad tiene como objetivo restaurar las propiedades de los tendones y músculos, adaptación del tejido local y disminución del dolor. Sin embargo, esta rehabilitación no contempla la modulación del control corticoespinal, y es por ello que existen déficits neuromusculares persistentes en el tendón de Aquiles después de la cirugía y fisioterapia a pesar de los resultados clínicos positivos (dolor-función). Existe una alta tasa de recurrencia, que podría deberse en parte a la ausencia de abordaje de la completa totalidad de aspectos que influyen en la tendinopatía42.
Se han identificado en estudios observacionales, pero aún no se han constatado en estudios prospectivos que cuenten a su vez con otras variables y mediadores. Es por ello imposible afirmar en la actualidad que la eliminación del factor asociado, elimine el riesgo de desarrollar la tendinopatía43.
Como factores de riesgo intrínsecos cabe destacar:
Como factores de riesgo extrínsecos, dado que resultan constituir los más susceptibles de modificación, se describen la carga, el nivel de actividad, el calzado o la superficie43.
Un buen examen subjetivo del paciente es importante en el diagnóstico de la tendinopatía para evitar confundirla con otras patologías que puedan existir y, de esta manera estar realmente seguros de estar lidiando con una verdadera tendinopatía. Una mala historia del paciente, por tanto, nos llevará a su vez, a un inadecuado tratamiento44.
Es por ello que el examen subjetivo debe ser extenso y considerar principalmente qué causó la afección y cómo responde la persona a la carga en el día a día.
La información demográfica es un factor vital que contribuye a la tendinopatía, donde factores como el sexo y la edad a menudo se asocian con síntomas, particularmente en áreas como la tendinopatía glútea y Aquilea. Del mismo modo, datos descriptivos de la tendinopatía como pueden ser la duración o la gravedad de los síntomas, pueden estar asociados con diferentes clínicas y dividir en distintos subgrupos a los pacientes dentro de un cierto tipo de tendinopatía. La información sobre la salud general y las comorbilidades en relación con los síntomas del tendón también debe recopilarse, siendo un factor de confusión importante para los resultados de tratamiento y particularmente influyente en afecciones como la tendinopatía de Aquiles44.
Se describen cinco claves para una gran evaluación subjetiva (Tabla 2):
|
CUADRO RESUMEN DE LAS PREGUNTAS DE UN EXAMEN SUBJETIVO |
|
|
|
|
|
Tabla 2. Preguntas en examen subjetivo.
Hay dos preguntas clave que se deben hacer cuando se examina a un paciente con dolor de tendón: ¿Dónde está el dolor? y ¿Qué agrava el dolor?
En cuanto a la primera pregunta, el dolor tendinoso siempre permanece en la zona del tendón, no se extiende por los alrededores ni cambia de lugar con la carga. Por lo tanto, se debe pedir que describa tanto el dolor en reposo como en carga, si se ve una diferencia entre ambos dolores, entonces probablemente no sea el tendón. La información clave que podemos obtener de esta pregunta es si el dolor se localiza en uno o dos dedos y si permanece en ese lugar independientemente de la actividad que realice44.
En cuanto a la segunda pregunta sobre qué agrava el dolor, se le pide al paciente que describa las actividades que le causan dolor en el tendón, esperaremos que describa acciones que requieran carga tensil o fuerzas de comprensión. Para el tendón de Aquiles o patelar describirán dolor en el tendón cambiando de dirección, saltando o corriendo con velocidad. Si las personas describen el dolor por la noche, puede estar relativamente seguro de que no se trata de dolor del tendón, sin embargo, por la mañana la primera carga en un tendón con frecuencia dará síntomas, particularmente en el tendón de Aquiles.
Otra pregunta que podemos hacer es: ¿Se lesionó cuando aparecieron los síntomas por primera vez?, los pacientes presentarán síntomas de dolor después de haber hecho un ejercicio de carga que no es el habitual para ellos, puede ser algo tan simple como cambiar el sitio de correr, un cambio en los zapatos, en la superficie de la pista, realizar un entreno intensivo, etc. Por ello, es muy importante preguntar aquello que cambió cuando aparecieron sus primeros síntomas44.
Otra pregunta importante es: Si haces más ejercicio del habitual, ¿se siente peor al día siguiente? El dolor tendinoso mejora a medida que se realiza una actividad, el tejido se calienta, pero al día siguiente aumenta el dolor. Por el contrario, el dolor en las articulaciones aumenta cada vez más a medida que realiza una actividad y se establece durante la noche, mejorando al día siguiente.
Otra pregunta clave es: ¿Qué ha hecho anteriormente para intentar disminuir su dolor de tendón? Comúnmente ocurre que cuanto más tiempo una persona ha tenido dolor, a más numerosas intervenciones se ha sometido. Muchas de ellas en realidad no son útiles ni para la patología ni para su dolor. Importante documentar si se han sometido a alguna terapia de inyección y cuales fueron, cuánto reposo ha mantenido y cuál fue la respuesta44.
También debemos documentar cuántas intervenciones activas y pasivas han recibido, a menudo muchos pacientes han intentado intervenciones pasivas (electroterapia, masoterapia, fricción transversa) que según la evidencia conseguirán un alivio del dolor a corto plazo, pero no serán efectivas a largo plazo. Si también han tenido intervenciones activas, es importante documentar el tipo de ejercicio que ha realizado, tipo de series y repeticiones, si tales ejercicios tuvieron un efecto en su tendón o no, etc. Pues con frecuencia los pacientes han utilizado cargas muy bajas (con una banda, ejercicios sin carga o ejercicios de carga usando el peso corporal) ineficaces para cambiar la capacidad de tolerar cargas del tendón, que es lo que queremos conseguir a largo plazo. De esta manera, realmente se puede analizar si sus intervenciones previas han sido útiles o no y que diferencias elegir en nuestro tratamiento para reducir el dolor del tendón del paciente44,45.
Los tendones se pueden visualizar con exquisito detalle con la resonancia magnética y la ecografía, permitiendo detectar áreas sutiles de anormalidad. Sin embargo, la estrategia de imagen más apropiada no es clara y la importancia clínica de los hallazgos encontrados es discutible45.
Es importante preguntarle al paciente en el examen subjetivo qué imagen le han realizado de su tendón. Sabemos que, en las imágenes de los tendones la estructura dañada y la patología no son importantes y posiblemente no sean la fuente de dolor. Por ejemplo, si tomáramos imágenes de los tendones rotulianos de los jugadores de baloncesto de la NBA, encontraríamos que aproximadamente el 50% de ellos tendría una patología del tendón rotuliano. De ellos, alrededor del 10-20% serían realmente sintomáticos. Por lo tanto, la patología en imágenes no es tan importante a nivel del tendón. Una de las cosas clave que le diríamos a un paciente después de mirar sus imágenes es que no son buenas para el diagnóstico, es decir, que no podemos mirar la imagen y decirle si ese tendón le va a causar dolor o si va a mejorar después de algún tratamiento45.
También hay que tener en cuenta que las pruebas de imagen no son una muy buena medida de resultado, ya que el tejido degenerativo no cambia a lo largo del tiempo y se verá exactamente igual con el paso de los años. Así, las medidas de resultado deben ser mucho más clínicas (dolor y función), no tanto sobre la imagen.
Otra cosa muy importante de entender es que los informes de los radiólogos son muy subjetivos y particularmente en las imágenes de ecografía. No existen criterios establecidos para que un radiólogo llame a algo como un tendón parcialmente roto, es decir un radiólogo podría decir que vio una rotura parcial y otro podría llamarlo un tendón patológico45.
Con la ecografía podemos visualizar el tejido conectivo alrededor de los tendones, podemos ver la hinchazón a su alrededor, la vascularización con el modo de flujo Doppler. Respecto a la resonancia magnética, también podemos obtener mucha información y probablemente sea mejor desde una perspectiva de diagnóstico diferencial. Lo que nos muestra es el aumento de agua dentro del tendón, nos indicará también el grosor del tendón aumentado, también puede visualizar muy bien las articulaciones y el cartílago alrededor del tendón45,46.
Otro tipo de pruebas de imagen son las imágenes con tensor de difusión, que nos permiten ver fibras y estructuras de colágeno, sin embargo, ninguno se ha utilizado en tendones.
Para comprobar la utilidad clínica de las imágenes en la tendinopatía se han realizado numerosos estudios que han investigado la precisión de diagnósticos correctos, estos estudios han demostrado consistentemente que tanto el ultrasonido como la resonancia magnética tienen una precisión de buena a excelente (ultrasonido, 0,63-0,83; resonancia magnética, 0,68-0,70) pero sensibilidad variable (ultrasonido, 0,68-0,87; resonancia magnética, 0,50-0,57) en la detección de la tendinopatía clínica46.
La caracterización del tejido por ultrasonido captura imágenes de ultrasonido transversales a lo largo del tendón y cuantifica la estabilidad de la textura del eco en 4 tipos de eco (tipo 1: haces tendinosos alineados; tipo 2: haces desestructurados; tipo 3: área focal degenerada; tipo 4: rotura parcial). Las investigaciones realizadas muestran que es capaz de distinguir entre diferentes tipos de tejido (granulación normal y tejido fibrótico) donde el ultrasonido básico de nivel de gris no pudo.
Por tanto, sería útil usar pruebas de imagen cuando hemos detectado alguna bandera roja, si está pensando en un diagnóstico diferencial que capture las estructuras fuera del tendón. Nunca debe usar las imágenes solo para confirmar el diagnóstico de tendinopatía, así como para justificar cualquier terapia inyectable o pasiva, las cuales no son buenas terapias en una tendinopatía y tampoco usarlas como seguimiento puesto que el área degenerativa no se va a remodelar y puede dañar la confianza del paciente ya que no ven ninguna mejora en la estructura44-46.
La evaluación objetiva consiste en confirmar o rechazar la hipótesis de que el paciente tiene dolor en el tendón, y luego, también, escribir una lista de tareas pendientes de lo que se necesita abordar en el proceso de rehabilitación (Tabla 3).
Entonces, tras la evaluación subjetiva, se debe tener una idea de cuánto necesitaremos examinar en función de las características que presente el paciente. Es clave comprender las demandas físicas de su deporte, pues no requerirá la misma evaluación una persona de edad avanzada que un deportista de élite, que será fundamental evaluar una función a un nivel alto para hacernos una idea de cuáles son sus déficits47.
|
PRINCIPIOS BÁSICOS DEL EXAMEN OBJETIVO |
|
|
|
Tabla 3. Principios básicos del examen objetivo.
Estudios afirman que las claves para el diagnóstico son la historia clínica y el examen físico. Este último debe incluir pruebas que carguen el tendón para reproducir el dolor. Después de considerar la historia y el comportamiento del dolor del tendón bajo la carga, la palpación cuidadosa junto con el conocimiento de la anotomía permite un diagnóstico clínico confiable. La palpación debe revelar la sensibilidad focal que esencialmente reproduce el dolor del paciente47.
Autores previos aseguraron la fiabilidad de la palpación como herramienta para localizar el dolor en el tendón. Especialmente tiene una elevada sensibilidad la palpación para el diagnóstico de la tendinopatía rotuliana, debido a que el tendón rotuliano se palpa fácilmente al encontrarse inmediatamente debajo de la piel y no tener peritendón sustancial. Por lo tanto, podemos afirmar que la sensibilidad a la palpación es un componente clave para diagnosticar la tendinopatía rotuliana.
La estructura de la evaluación, comenzará con una observación, necesitaremos asegurarnos de que podamos ver todo su miembro inferior y lo que trataremos de encontrar es cualquier atrofia o desgaste muscular.
Luego debemos llevar a cabo una serie de pruebas de provocación del dolor en el paciente a nivel de su función. Aplicaremos pruebas específicas en cada tendón y todas ellas deben contemplar las dos preguntas siguientes: ¿Dónde duele? y ¿Cuánto duele del 1 al 10? Se considerará un dolor aceptable del 1-4 y del 5-10 una zona de alto riesgo.
Finalmente, también evaluaremos críticamente la función del paciente, por ejemplo, si es un corredor observaremos el salto, porque correr es una sucesión de saltos47.
Cada diagnóstico será específico para cada tendón.
Los factores de riesgo se clasifican en: factores de riesgo modificables y no modificables.
El factor modificable más importante claramente es la carga. Sabemos que un cambio en la carga, particularmente el aumento de esta, puede inducir dolor en el tendón. La pregunta que debe hacerse es: ¿ha tenido alguna otra lesión en el último año? Esto es así porque es muy común que los pacientes presenten dolor de tendón después de un periodo en descarga a causa de una lesión, puesto que el retorno al entrenamiento habitual en realidad implica un aumento de carga dado que la capacidad del tendón ha disminuido y puede causar dolor en el tendón48.
El segundo factor modificable es la sección de carga, está relacionado con actividades como el cambio de aparatos ortopédicos, zapatos o superficies, que cambian la interacción entre el tendón y la superficie de apoyo del pie. Y eso, nuevamente es un cambio de carga importante.
El tercer factor de riesgo modificable es la carga de dorsiflexión. Este es el caso particular de personas que han tenido un esguince de tobillo o aquellas que tienen un tobillo rígido de forma natural. Se sabe que con movilizaciones o estiramientos del tendón de Aquiles y rotuliano podemos permitir un mayor rango de dorsiflexión, y eso nos permite absorber más energía en el complejo del tobillo y quitaría carga al tendón47,48.
El último factor modificable sería el peso corporal. Lo que sabemos es que cuando aumenta el peso corporal, se crea más estrés mecánico en el tendón. Además, también sabemos que la grasa visceral es muy proinflamatoria y que genera muchos cambios sistémicos y cambios inflamatorios en el cuerpo. A su vez, esto aumenta las posibilidades de una persona de desarrollar diabetes y resistencia a la insulina, lo que puede conducir a un colesterol alto. En cuanto a las implicaciones en los tendones, como sabemos, el colesterol puede depositarse en los tendones y afectarlos directamente. La diabetes tipo II está fuertemente implicada por depósito del producto final glucagón en el tendón y puede endurecer los tendones y con ello cambiar la respuesta del tendón a la carga.
Se han determinado los siguientes cuatro elementos como características modificables del paciente que funcionaron como factores de riesgo para la tendinopatía de Aquiles:
También se ha concluido que las lesiones ecográficas del tendón rotuliano se producen en jugadores de élite de baloncesto asintomáticos de 14-18 años, lo que sugiere que la tendinosis rotuliana puede comenzar en la edad adulta. Se debe incluir esta condición en el diagnóstico diferencial del dolor anterior de la rodilla en el atleta joven que salta. Esto puede sugerir que ciertas actividades deportivas pueden predisponer a los atletas a desarrollar tendinopatía47.
Existen varios factores que pueden afectar a la patología del tendón que la persona o los sanitarios no pueden modificar.
El primero de ellos es la genética, la investigación muestra que el gen COL5A1 está implicado en el riesgo de tener tanto patología tendinosa como dolor en el tendón. Las enfermedades de colágeno tipo 1, como el síndrome de Marfan también pueden afectar al tendón. También se ha determinado que los polimorfismos de la longitud del fragmento BstUi están asociados con la tendinopatía crónica de Aquiles48.
El segundo factor es cualquiera de las enfermedades autoinmunes, como la artritis psoriásica, el síndrome del escritor, la colitis ulcerosa, etc. A menudo estos pacientes presentan un problema de inserción de Aquiles. Se deben hacer todas las preguntas clave para identificar estas patologías, si el paciente parece tener una enfermedad autoinmune es realmente importante que se controle primero antes de intentar controlar la afección del tendón. Si primero se intenta controlar la condición del tendón, mientras la enfermedad autoinmune aún está activa, no se obtendrá un buen resultado.
El tercer factor que es importante en las mujeres es la menopausia, sabemos que se encuentra implicada en la presentación de la patología y dolor del tendón. Entonces, una vez que están en un estado premenopáusico o posmenopáusico, estarán en riesgo de sufrir patología tendinosa48.
El último factor de riesgo son los antibióticos fluoroquinolonas, que generalmente son tomados por personas que están muy enfermas, para tratar infecciones del tracto urinario y del tracto respiratorio. Hay evidencia de que el tendón puede romperse dentro de los seis días posteriores de tomar los medicamentos. Stephenson y col et al., (2013) sugirieron en una revisión que existe una asociación significativa entre el uso de la fluoroquinolona y la lesión del tendón, en particular con la ruptura del tendón de Aquiles y la tendinopatía. Por tanto, una de las preguntas clave que debe hacerle a sus pacientes es ¿Ha tomado antibióticos recientemente? Y si es así, ¿de qué tipo eran? Si se trata de fluoroquinolonas, debe cambiar la estrategia terapéutica ya que los tendones no van a responder a nuestras intervenciones con carga48.
Otros factores de riesgo no modificables para la tendinopatía de Aquiles son:
Podemos destacar que se han identificado diversos factores de riesgo en estudios observacionales (Tabla 4), pero aún no en estudios prospectivos que tengan en cuenta otras variables y mediadores. Con esto en cuenta no se puede afirmar que la eliminación del factor asociado elimine el riesgo de desarrollar la tendinopatía46-48.
|
FACTORES DE RIESGO MODIFICABLES |
FACTORES DE RIESGO NO MODIFICABLES |
|
|
|
2. Enfermedad autoinmune |
|
3. Menopausia |
|
|
Tabla 4. Principales factores de riesgo.
Es común en corredores de larga distancia, saltadores de obstáculos o corredores de montaña. También puede afectar en aquellos deportes en los que existen muchos cambios de dirección como puede ser el hockey o el fútbol. En cuanto a las presentaciones clínicas de esta patología tenemos: dolor profundo y localizado en la tuberosidad isquiática que empeora durante actividades como correr, saltar, cuclillas o sentarse. Se considera esta tendinopatía como una patología de inserción (entesopatía). Al realizar flexión y aducción de cadera, el tendón se comprime y provoca dolor, este es un factor etiológico grave. Cuanto mayor es el grado de flexión de cadera, mayor desplazamiento del tendón y mayor compresión50.
Existen factores extrínsecos e intrínsecos que pueden favorecer la aparición de esta patología. Entre los extrínsecos podemos encontrar el uso excesivo de estiramientos estáticos en flexión de cadera y entre los intrínsecos la edad o problemas metabólicos.
En esta patología, la valoración es de vital importancia porque hay otras entidades clínicas que pueden dar un dolor similar en esta misma zona. Es muy importante la historia clínica.
En la tendinopatía isquiotibial proximal, existe un dolor bien localizado en la tuberosidad isquiática y que con el calentamiento del ejercicio se reduce y que vuelve a incrementarse tras la realización de la actividad y a las 24 horas de la realización de la misma. Este dolor se produce en actividades donde hay una liberación y almacenamiento de energía o en sedestaciones mantenidas durante mucho tiempo, debido a la compresión y a la flexión de cadera50.
Otras cosas a valorar son la anteversión pélvica, la movilidad de cadera, la fuerza de los isquiotibiales y la técnica de carrera.
Existen diversos test de carga en los cuales el tendón isquiotibial proximal está sometido a un gran estrés y reproduce el dolor a punta de dedo. Uno de ellos es un puente glúteo unilateral con la cadera en flexión, con el talón apoyado en un banco. Otro test utilizado es un peso muerto unilateral51.
El tratamiento con mayor evidencia es la realización de ejercicio físico. El tratamiento se divide en 4 fases, donde el tipo de ejercicios va variando y progresando conforme la patología va mejorando.

Figura 14. Entrenamiento de puente pélvico en tendinopatía isquiosural.
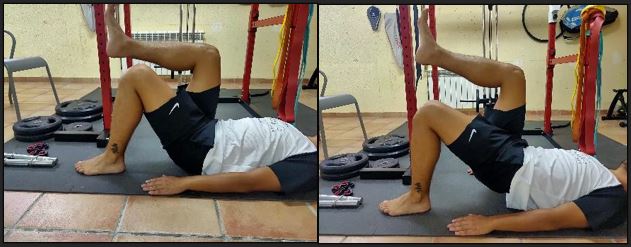
Figura 15. Entrenamiento de puente pélvico unilateral.

Figura 16. Entrenamiento de almacenamiento de energía: subida a escalón.
La tendinopatía rotuliana o patelar es aquella que afecta al tendón rotuliano, que une la rótula a la tibia. Es un dolor ligado con la carga que se aumenta cuando existe una gran demanda de los extensores de rodilla y en actividades donde hay liberación y almacenamiento de energía en la rótula. Es una patología que se suele dar en atletas jóvenes, hombres en su mayoría, y en deportes de salto52.
Existe un dolor a punta de dedo en el polo inferior de la rótula que siempre está relacionado con la carga de los extensores de rodilla. Es muy importante comprender que siempre está relacionado con la carga y en caso de no ser así habría que sospechar de otra patología. Debido a la naturaleza de este dolor, se le denomina ON/OFF.
El dolor debe ser medido al menos en dos momentos distintos: durante la realización de la actividad y a las 24 horas. La forma más sencilla de medir el dolor es la escala EVA, que va desde 0 a 10, siendo 0 no dolor y 10 el máximo dolor imaginable. Esto es importante puesto que cierto dolor durante la actividad es totalmente normal y el paciente debe saber controlarlo y en qué punto es momento de parar. Las 24 horas son una señal de cómo ha sido el trabajo realizado durante la sesión. Si el dolor es igual o menor que el día anterior, el trabajo realizado ha resultado positivo. Por el contrario, si el dolor se ha incrementado con respecto al día anterior, la sesión fue demasiado exigente53.
Es importante valorar no solo el tendón y el aparato extensor de la rodilla sino toda la cadena cinética. En cuanto a la valoración de fuerza, se pueden usar test de fuerza resistencia como el puente glúteo unilateral para medir de glúteo e isquiosurales o el test de elevaciones de gemelo para medir tríceps sural. A la hora de cuantificar la fuerza de los extensores de rodilla, una de las opciones es realizar la medición con un dinamómetro manual. En cuanto a la movilidad, cobra importancia la medición de la dorsiflexión de tobillo y la flexibilidad de los isquiosurales y los cuádriceps53.
Existen diversos test de carga en los cuales el tendón rotuliano está sometido a un gran estrés y reproduce el dolor a punta de dedo. Uno de ellos es el test de extensión de cuádriceps, pero el más usado es el test de sentadilla unilateral sobre plataforma declinada52,53.
El tratamiento con mayor evidencia es la realización de ejercicio físico. El tratamiento se divide en 4 fases, donde el tipo de ejercicios va variando y progresando conforme la patología va mejorando.
Figura 17. Trabajo isotónico de cuádriceps.
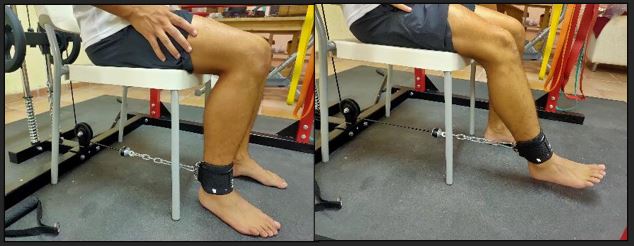
Figura 18. Trabajo específico de extensión de rodilla en fase 2.

Figura 19. Entrenamiento de almacenamiento de energía: salto y recepción.
Es una patología común en corredores ya que puede suponer hasta el 15% del total de las lesiones. No obstante, la población sedentaria también es candidata a desarrollar esta tendinopatía. En cuanto a la edad, es más común entre los 30 y los 50 años. Es frecuente en deportes de larga distancia y en deportes multidireccionales54.
Es un tendón muy poco vascularizado, en especial en la zona media del tendón y por eso se considera esa zona como zona crítica. La disposición de las fibras del tendón ayuda a la liberación de energía durante la marcha y está envuelto por una vaina sinovial54.
El tendón de Aquiles está sometido a tres tipos de cargas:
Es muy importante realizar una buena historia clínica para descubrir si ha existido un cambio importante en la carga. El dolor tendinoso es un dolor localizado y dependiente de la carga, también conocido como un dolor ON/OFF. Existe una disminución de la fuerza del tríceps sural y una rigidez matutina que se disminuye con el paso del tiempo. El test diagnóstico es el London Hospital Test que consiste en palpar el tendón en flexión plantar y dorsal55.
Es importante valorar toda la cadena cinética. A nivel del tríceps sural se debe realizar la elevación de talón en isometría y la elevación de talón sentado. En cuanto al tobillo se debe valorar la fuerza tanto de inversores como de eversores. Además, es importante valorar la fuerza de los isquios con un puente glúteo a una pierna y el glúteo medio con una elevación lateral de la pierna. La fuerza de cuádriceps también podría ser interesante en algunos casos54.
Tests de carga
Dependiendo del nivel de irritabilidad del tendón se podrán usar distintos tests de carga para reproducir el dolor. Podemos usar tests como andar o correr, elevación de talones, saltos bilaterales y unilaterales54.
Tratamiento
Antes de hablar del tratamiento de la tendinopatía aquílea propiamente dicha, se comentarán dos entidades clínicas relacionadas con el tendón54.
El tratamiento con mayor evidencia es la realización de ejercicio físico. El tratamiento se divide en 4 fases, donde el tipo de ejercicios va variando y progresando conforme la patología va mejorando.
El ejercicio de elección es elevación de talones en isometría y en caso de ser posible se realiza de manera unilateral. La dosis de los ejercicios debe ser de 4 series de 45 segundos, realizándose 2 veces al día durante unas 3 semanas54.

Figura 20. Fase 1 de carga isométrica.
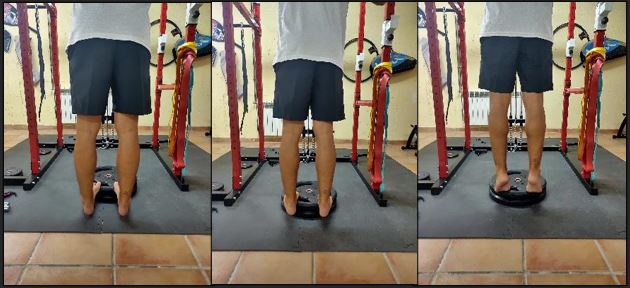
Figura 21. Fase 2 de carga isotónica: elevación de talones.
La dosis recomendada es de 3 a 4 series con una carga correspondiente al 15 RM hasta llegar al 6RM, realizándolo cada 2 días y con 2 minutos de descanso entre series. Además, los ejercicios que se realizaban durante la fase 1 se deben de mantener ya que ayudarán a mantener controlado el dolor. Hay diversos ejercicios que se pueden realizar en esta fase como son la elevación de talones en máquina Smith o la prensa con talón54.
Los ejercicios de elección en esta fase pueden ser andar sobre punteras, saltos bajos o subir escaleras y se debe incrementar de manera progresiva según la respuesta que vaya dando el tendón 2 horas después de la realización de la actividad54,55 (Figura 22).
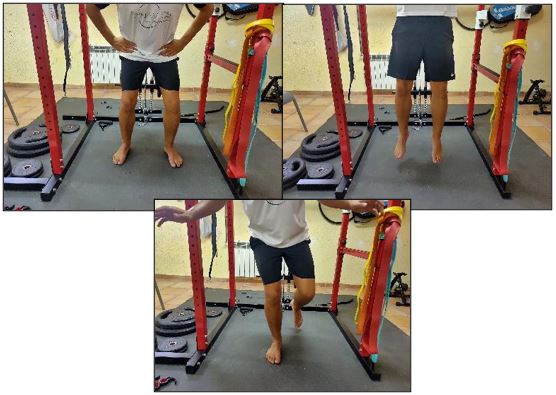
Figura 22. Entrenamiento de almacenamiento de energía: salto y recepción.
Fase 4 (entrenamiento específico): Para llegar a esta fase el paciente ha de haber completado las progresiones de almacenamiento de energía que replican las demandas de su deporte. Es un retorno gradual al entrenamiento que se realiza cada 2-3 días. Se deben mantener los ejercicios de las dos primeras fases con el objetivo de aumentar la fuerza y la tolerancia del tendón55.
14. TENDINOPATÍA GLÚTEO MEDIO
Introducción y clínica
El típico caso de tendinopatía del glúteo medio es el de una mujer post menopáusica. Se sabe que esto tiene que ver con el hecho de que las hormonas femeninas son protectoras de diferentes tejidos como los tendones. Además del hecho de la menopausia, esta patología también está relacionada con la forma de la pelvis de las mujeres en comparación con la pelvis de los hombres. El ángulo Q es mayor, lo que causa una mayor compresión del tendón y la bursa alrededor del trocánter mayor56.
Valoración
Durante la exploración de la tendinopatía glútea, por regla general los pacientes están bastante incapacitados y no hay que sobre examinarlos. A veces, simplemente con hacer que se mantengan de pie a una pierna es suficiente para provocar dolor. Esto puede ocurrir porque si no son lo suficientemente fuertes para mantenerse a una pierna, la hemipelvis se cae e inmediatamente ese lado se comprime. En caso de querer aumentar la compresión, se les podría pedir que bajaran un escalón o realizar movimientos de rotación interna y externa de cadera. El incremento de la compresión bajando un escalón provocará los síntomas de la paciente. Estos pacientes son también muy sensibles a la palpación y hay otros test de movilidad de cadera que provocan dolor. No necesitan mucho examen, están muy incapacitados56.
Diagnóstico diferencial
Tests de carga
El test de carga más utilizado para someter a tensión el tendón del glúteo medio es estar de pie de forma monopodal56.
Tratamiento
Hay dos cosas a tener en cuenta en el tratamiento de la tendinopatía del glúteo medio. La primera es que, si existe un diagnóstico de bursitis glútea o del glúteo medio, también tienes una tendinopatía. Segundo, si irritas la bursa, también irritas el tendón porque están íntimamente relacionados. Esto tiene importancia clínica puesto que muchas veces a las mujeres les ofrecen inyecciones de cortisona para administrar a la bursa, que les puede reducir el dolor durante un tiempo, pero si no se soluciona el componente compresor de la tendinopatía, el dolor volverá. Así que, si la cortisona es parte del tratamiento, es muy importante saber que, en el periodo de no dolor, es el momento ideal para abordar los problemas de compresión de ese tendón57.
El tratamiento se basará en un programa de ejercicio individualizado y se dividirá como en las anteriores patologías en 4 fases.
La dosis de los ejercicios debe ser de 4-5 series de 45 segundos, realizándose 2 veces al día56.
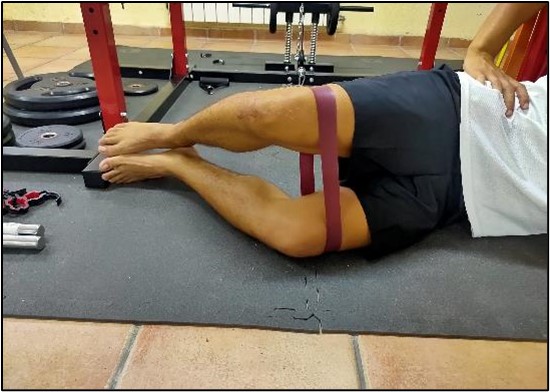
Figura 23. Abducción en carga isométrica.
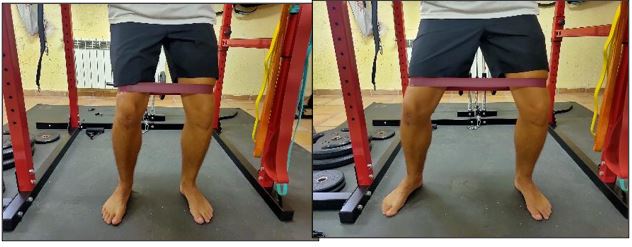
Figura 24. Entrenamiento isotónico de musculatura abductora.
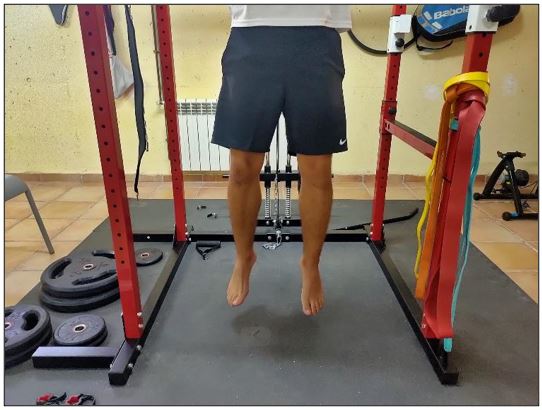
Figura 25. Entrenamiento en fases de almacenamiento de energía y específico: pliometría en salto.
15. REFERENCIAS BIBLIOGRÁFICAS